ОГЛАВЛЕНИЕ
Обозначения основных
величин
Предисловие
ГЛАВА 1. Принципиальная схема
паровоздушной конверсии метана
ГЛАВА 2. Обоснование выбора
схемы химических превращений
ГЛАВА 3. Балансовые уравнения
для процесса первичного реформинга
3.1. Уравнения материального баланса
3.2. Приближение квазиравновесного
режима реакции паровой конверсии монооксида
углерода
3.3. Расчет равновесной степени
конверсии метана
3.4. Уравнение баланса энергии
ГЛАВА 4. Уравнения
материального и энергетического баланса для
вторичного реформинга метана
4.1. Расчет потока воздуха для приготовления
азотоводородной смеси требуемого состава
4.2. Оценка адиабатного разогрева смеси
в головной части шахтного реактора
4.3. Уравнения энергетического баланса
для реактора в целом
4.4. Расчет равновесной степени
конверсии метана в шахтном реакторе
ГЛАВА 5. Уравнения
материального и энергетического баланса для
реакторов паровой конверсии монооксида углерода
5.1. Материальный баланс
5.2. Уравнение энергетического баланса
5.3. Расчет равновесной степени
превращения
Литература
Обозначения основных величин
Сp,i – теплоемкость i-го газа; Дж К-1моль-1
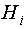 – молярная энтальпия i-го
вещества; Дж моль-1
– молярная энтальпия i-го
вещества; Дж моль-1
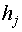 – удельная энтальпия j-го
потока; Дж кг-1
– удельная энтальпия j-го
потока; Дж кг-1
КР,i – константа равновесия i-й реакции
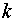 – число химических
компонентов в материальном потоке
– число химических
компонентов в материальном потоке
l – общее число входов и выходов материальных
потоков в системе
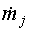 – материальный поток
через j-й вход (выход) системы; кг с-1
– материальный поток
через j-й вход (выход) системы; кг с-1
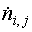 – поток i-го
химического элемента через j-й вход (выход)
системы; моль с-1
– поток i-го
химического элемента через j-й вход (выход)
системы; моль с-1
р – общее давление в смеси; атм
рi – парциальное давление i-го
газового компонента в смеси; атм
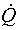 – скорость подвода
теплоты к системе; Дж с-1
– скорость подвода
теплоты к системе; Дж с-1
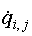 – абсолютная величина
потока i-го вещества на j-м входе (выходе)
системы; моль с-1
– абсолютная величина
потока i-го вещества на j-м входе (выходе)
системы; моль с-1
R – газовая постоянная; Дж К-1моль-1
Т – абсолютная температура; К
Т * – температура адиабатного
разогрева смеси; К
хi – мольная доля i-го компонента в
смеси
 – отношение потока кислорода,
поступающего в шахтный реактор, к потоку метана,
подаваемого на конверсию в трубчатую печь.
– отношение потока кислорода,
поступающего в шахтный реактор, к потоку метана,
подаваемого на конверсию в трубчатую печь.
 – отношение пар : метан на
входе в реакционные трубы трубчатой печи
– отношение пар : метан на
входе в реакционные трубы трубчатой печи
 – отношение суммарного
количества водорода и монооксида углерода к
азоту на выходе шахтного реактора
– отношение суммарного
количества водорода и монооксида углерода к
азоту на выходе шахтного реактора
 rСp –
изменение теплоемкости при r-й реакции; Дж К-1
моль-1
rСp –
изменение теплоемкости при r-й реакции; Дж К-1
моль-1
 rG0 –
изменение стандартной энергии Гиббса при r-й
реакции; Дж моль-1
rG0 –
изменение стандартной энергии Гиббса при r-й
реакции; Дж моль-1
 H0f,i –
стандартная энтальпия образования i-го
вещества; Дж моль-1
H0f,i –
стандартная энтальпия образования i-го
вещества; Дж моль-1
 rH – изменение
энтальпии при r-й реакции; Дж моль-1
rH – изменение
энтальпии при r-й реакции; Дж моль-1
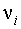 – стехиометрические
коэффициенты реакции
– стехиометрические
коэффициенты реакции
 –
степень конверсии метана
–
степень конверсии метана
 -
количество подведенной теплоты к реакционным
трубам трубчатой печи в расчете на 1 моль метана,
поступающего на конверсию; Дж моль-1
-
количество подведенной теплоты к реакционным
трубам трубчатой печи в расчете на 1 моль метана,
поступающего на конверсию; Дж моль-1
 – доля метана, окисленного до диоксида углерода
– доля метана, окисленного до диоксида углерода
ПРЕДИСЛОВИЕ
Настоящее пособие служит дополнением к Выпуску
1 "Избранных глав химической технологии"[1] и целиком посвящено методу
интегральных уравнений баланса потоков вещества
и энергии в анализе химико-технологических
систем.
Эти уравнения выражают количественные
соотношения между химическими составами и
теплосодержанием материальных потоков,
поступающих в систему и покидающих ее. Интегральными
такие уравнения называют в силу того, что они
характеризуют происходящие в системе
превращения в целом, в отличие от дифференциальных
уравнений материального и энергетического
баланса, характеризующих локальные изменения
состояния исследуемой системы.
Метод интегральных уравнений баланса можно
отнести к начальным, азбучным положениям в
теоретическом арсенале химической технологии.
Его роль определяется двумя обстоятельствами. С
одной стороны, интегральные соотношения
являются прямым следствием фундаментальных законов
сохранения массы вещества, массы каждого из
химических элементов и энергии в химических
процессах. С другой стороны, в этом методе
используются самые скромные математические
средства: в применении к стационарным
технологическим процессам интегральные
соотношения представляют собой алгебраические
уравнения; для периодических процессов эти
соотношения выражаются через интегралы по
периоду процесса, то есть через средние по
периоду параметры потоков.
Можно выделить две сферы приложений
интегральных балансовых уравнений. Первая –
анализ эффективности действующих
технологических объектов или опытных установок,
включая контроль точности используемых
экспериментальных методов определения состава и
термодинамических параметров потоков.
Принципиально важно, что применение метода не
предполагает знания детальной структуры
исследуемой системы и механизма протекающих в
системе процессов. Вторая сфера – математическое
моделирование технологических объектов.
Полноценные математические модели
технологических процессов, как правило,
представляют собой системы дифференциальных
уравнений в частных производных. Однако во
всяком случае решения дифференциальных
уравнений должны удовлетворять элементарным
балансовым соотношениям, выражающим первичные
законы природы. Поэтому балансовые соотношения
либо включают в саму схему расчетов, либо они
служат для проверки точности вычислительных
процедур.
Составление уравнений баланса потоков
химических веществ и энергии предшествует
эксергетическому анализу технологического
объекта с целью оценки его термодинамической
эффективности.
В качестве представительного примера для
иллюстрации метода выбрана распространенная
технологическая схема паровоздушной конверсии
природного газа в производстве аммиака,
разработанная фирмой "Келлог". Данный
пример показателен с той точки зрения, что
взаимосвязанные балансы потоков вещества и
энергии заложены в саму основу сложной
технологической схемы.
Многоступенчатая схема конверсии газа,
фактические данные по которой отражены в
специальной справочной литературе [2, 3,
4], в особенности удобна для рассмотрения
различных тепловых режимов химических
реакторов.
В предлагаемом пособии особый акцент сделан на
дополнительные возможности в применении
балансовых уравнений, когда к ним присоединяют
асимптотические соотношения, выражающие те или
иные гипотезы о различии характерных временных
масштабов протекающих в системе процессов.
Примером такого рода гипотез может служить
представление о малых временах протекания
необратимых реакций окисления горючих газов в
головной части реактора вторичного реформинга
метана по сравнению с характерным временем
целевой реакции (см. раздел 4.2).
Другие примеры – модель квазиравновесного
протекания реакции взаимодействия монооксида
углерода с водяным паром как при первичном, так и
вторичном реформинге метана, а также
представление об асимптотическом приближении к
полному химическому равновесию в реакционной
смеси при достаточно больших временах
пребывания смеси в каталитическом реакторе. Во
всех перечисленных случаях балансовые уравнения
позволяют вывести полезные предельные
соотношения, не прибегая к интегрированию
нелинейных дифференциальных уравнений.
Материал пособия служит иллюстрацией
приложения к задачам технологии целого ряда
методов физической химии: расчета равновесий
газофазных реакций; выделения линейно
независимых уравнений химических реакций,
полностью характеризующих макроскопическое
изменение состава смеси; принципа
квазиравновесного прохождения реакции;
представления об адиабатном разогреве
(охлаждении) реакционной смеси в каталитическом
реакторе.