5.2. Уравнение энергетического баланса.
Уравнение энергетического баланса (40) для адиабатного реактора, с учетом уравнений (19), применительно к реактору 5 имеет вид:
0 = ![]() HH2(T6)
+
HH2(T6)
+![]() HCO(T6)
+
HCO(T6)
+![]() HH2O(T6)
+
HH2O(T6)
+
+![]() HCO2(T6)
+
HCO2(T6)
+![]() HCH4(T6)
+
HCH4(T6)
+![]() HN2(Т6)
+
HN2(Т6)
+![]() HAr (Т6)-
HAr (Т6)-
-![]() HH2(T5)
-
HH2(T5)
-![]() HCO(T5)
-
HCO(T5)
-![]() HH2O(T5)
-
HH2O(T5)
-![]() HCO2(T5)-
HCO2(T5)-
-![]() HCH4(T5)-
HCH4(T5)-
![]() HN2 (Т5)-
HN2 (Т5)-
![]() HAr (Т5)
. (73)
HAr (Т5)
. (73)
Подставляя в (73) выражения (58) - (60) для потоков веществ-участников реакции (2) и тождество
![]() =
= ![]() - (
- (![]() -
- ![]() ) ,
) ,
а также равенства (72) для инертных компонентов, получим
0 = (![]() -
- ![]() ) [HH2(T6) - HCO(T6)
-HH2O(T6) +HCO2(T6)]+
) [HH2(T6) - HCO(T6)
-HH2O(T6) +HCO2(T6)]+
+![]() [HH2(T6)
- HH2(T5)] +
[HH2(T6)
- HH2(T5)] +![]() [HCO(T6) - HCO(T5)]
+
[HCO(T6) - HCO(T5)]
+
+![]() [HH2O(T6)
- HH2O(T5)] +
[HH2O(T6)
- HH2O(T5)] +![]() [HCO2(T6) - HCO2(T5)]+
[HCO2(T6) - HCO2(T5)]+
+![]() [HCH4(T6)
- HCH4(T5)] +
[HCH4(T6)
- HCH4(T5)] + ![]() [HN2 (Т6) - HN2 (Т5)]+
[HN2 (Т6) - HN2 (Т5)]+
+![]() [HAr (Т6)
- HAr (Т5)] (74)
[HAr (Т6)
- HAr (Т5)] (74)
или
| 0 = ( | - | ) | 2H(Т6)+ |  |
, (75) |
где k - число всех компонентов в смеси, поступающей на вход 5 реактора.
В приближении постоянства теплоемкостей газов (23) - (26) и с учетом соотношений (65) и (68) имеем:
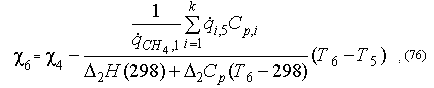
где потоки ![]() определяются
по уравнениям (62) - (67).
определяются
по уравнениям (62) - (67).
Уравнение энергетического баланса (75) можно
разрешить также относительно Т6 .
Представим ![]() 2H(Т6)
как
2H(Т6)
как ![]() 2H(Т5)+
2H(Т5)+![]() 2CP(Т6-Т5),
тогда:
2CP(Т6-Т5),
тогда:
 . (77)
. (77)
Найденная зависимость Т6(![]() 6 ) является
возрастающей. Так как на промежутке от входа
реактора до любого его поперечного сечения
процесс конверсии СО протекает в адиабатных
условиях, уравнение (77) можно использовать для
описания профиля температуры внутри реактора,
понимая под Т6 и
6 ) является
возрастающей. Так как на промежутке от входа
реактора до любого его поперечного сечения
процесс конверсии СО протекает в адиабатных
условиях, уравнение (77) можно использовать для
описания профиля температуры внутри реактора,
понимая под Т6 и ![]() 6 соответственно текущие
температуру и координату процесса конверсии
монооксида углерода.
6 соответственно текущие
температуру и координату процесса конверсии
монооксида углерода.
5.3. Расчет равновесной степени превращения.
Ясно, что степень превращения CO в СО2 по
реакции (2) в реакторе 5 не может превысить
равновесного значения. Для нахождения
предельного, равновесного значения параметра ![]() 6
выразим константу равновесия реакции (2) через
мольные доли компонентов:
6
выразим константу равновесия реакции (2) через
мольные доли компонентов:
КР,2(Т6 ) =  =
=  , (78)
, (78)
мольная доля i-го вещества в потоке 6 рассчитывается по уравнению
![]() =
=  ,
,
где ![]() - число веществ в
потоке 6. Сокращая числитель и знаменатель (78) на
величину
- число веществ в
потоке 6. Сокращая числитель и знаменатель (78) на
величину  и подставляя
выражения потоков (68) - (71), получим уравнение,
аналогичное уравнению (50) для Ш.Р.:
и подставляя
выражения потоков (68) - (71), получим уравнение,
аналогичное уравнению (50) для Ш.Р.:
![]()
![]() 62 +
62 + ![]()
![]() 6 +
6 + ![]() = 0 , (79)
= 0 , (79)
где ![]() = 1-КР,2;
= 1-КР,2; ![]() = (3-2
= (3-2![]() )
)![]() 4 + КР,2
(
4 + КР,2
(![]() +2
+2![]()
![]() 4);
4);
![]() = -КР,2
= -КР,2![]() 4 [
4 [![]() +(2
+(2![]() -1)
-1)![]() 4] .
4] .
Рассуждения, аналогичные тем, которые были приведены при анализе уравнения (15) для Т.П. и уравнения (50) для Ш.Р., позволяют сделать вывод, что (79) имеет единственное решение, обладающее физическим смыслом:
![]() 6 =
6 =
 . (80)
. (80)
Равновесная величина ![]() 6 является функцией Т6
(через константу КР,2) . Уравнение (80) и
уравнение энергетического баланса (76) совместно
определяют равновесные значения как состава
смеси, так и температуры на выходе реактора
конверсии монооксида углерода. Решение этой
системы уравнений может быть найдено, в
частности, графическим способом.
6 является функцией Т6
(через константу КР,2) . Уравнение (80) и
уравнение энергетического баланса (76) совместно
определяют равновесные значения как состава
смеси, так и температуры на выходе реактора
конверсии монооксида углерода. Решение этой
системы уравнений может быть найдено, в
частности, графическим способом.
В промышленных конвертерах монооксида углерода достигается степень превращения СО до 98% от равновесной для конвертера первой ступени и до 97% - для конвертера второй ступени [2, 4] .
Упражнение.
Катализатор первой ступени конверсии
монооксида углерода имеет рабочий интервал
температур от 593 до 793 К. Состав смеси на выходе
Ш.Р. отвечает параметрам ![]() 4=0.973,
4=0.973, ![]() 4=0.45,
4=0.45, ![]() =4,
=4, ![]()
![]() 0.300. Возможно ли достижение на
выходе реактора первой ступени равновесной доли
0.300. Возможно ли достижение на
выходе реактора первой ступени равновесной доли ![]() 6=0.92,
и если возможно, то при каких условиях?
6=0.92,
и если возможно, то при каких условиях?
ЛИТЕРАТУРА