Тема 5. Обратимые реакции
1.
Истинная концентрация реагента А изменяется со временем так, как указано в
задаче 1 (тема 4). Найти константу скорости прямой и обратной реакции в
предположении, что это обратимая реакция 1-го порядка А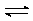 В.
В.
2.
Одна из самых быстрых известных реакций 2-го порядка – рекомбинация ионов Н+
и ОН-
в водных растворах: для нее константа скорости равна 2´1011
л/(моль·с).
Найти среднее время жизни атома водорода в составе молекулы воды в жидкой фазе.
Диссоциирует ли вода в газовой фазе?
3.
Гидратация СО2 -
медленная реакция с временем полупревращения около 5 с при температуре тела
человека. Константа скорости обратной реакции распада Н2СО3
в 500 раз больше. Найти равновесную концентрацию угольной кислоты в плазме
крови, если концентрация СО2 в ней равна 0,0012 моль/л.
4.
В сосуд вводили смеси водорода и паров иода и измеряли кинетику реакции.
Провели четыре опыта: первый и второй – при 200 и 400 оС и равных
концентрациях реагентов; третий и четвертый – при тех же температурах и [Н2]:[I2]
= 5:1. Можно ли в каждом опыте считать реакцию необратимой? (Реакцию считать
необратимой, если скорость обратной реакции после достижения равновесия не
превышает 3% от скорости реакции в начальный момент времени.) Константы
равновесия при указанных температурах равны 63 и 163.
5.
Для обратимой реакции цис-транс-изомеризации найти выражение для времени
полупревращения, если начальная концентрация транс-изомера равна нулю.
6.
При каком значении константы равновесия скорость приближения к равновесию
реакции A + B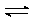 2С подчиняется закону первого порядка?
Рассмотреть случаи:
2С подчиняется закону первого порядка?
Рассмотреть случаи:
а) [А]0 = [В]0, [С]0 =
0; б) [А]0¹ [В]0¹ [С]0¹
0.
7.
За кинетикой обратимой реакции А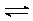 В следили поляриметрически.
В следили поляриметрически.
Независимо определили
константу равновесия, которая равна 0,542. Найти константы скорости прямой и
обратной реакций.
| t /мин | 0 | 1 | 20 | 30 | 40 | ¥ |
| a/град | +6,15 | 5,84 | 0,43 | -1,52 | -3,05 | -8,45 |
8.
В растворах 2-метил-2-нитрозопропана (t-BuNO)
устанавливается равновесие между мономерной и димерной формой соединения: Д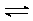 2М. Константа равновесия K = [M]2/[Д]
= 2,5 моль/л при 20oС. Рассчитать степень диссоциации димера при
исходной концентрации (в расчете на мономер) 0,05 и 0,005 моль/л.
2М. Константа равновесия K = [M]2/[Д]
= 2,5 моль/л при 20oС. Рассчитать степень диссоциации димера при
исходной концентрации (в расчете на мономер) 0,05 и 0,005 моль/л.
В
общем случае кинетика приближения системы к равновесию описывается сложным
уравнением. Показать, что в случае разбавленных растворов (концентрация в
расчете на мономер менее 0,05 М), когда степень диссоциация близка к 100%,
кинетика приближения системы к равновесию двумя методами (см. ниже) описывается
простым уравнением 1-го порядка. Учесть, что экспериментально за кинетикой
реакции следят по оптическому поглощению димера. Вывести уравнение, описывающее
зависимость этого поглощения D от
времени в указанных упрощающих условиях разбавленных растворов.
Экспериментально
константы скорости определяют релаксационными методами:
а)
при использовании метода концентрационного скачка раствор, содержащий при
данной температуре равновесную смесь мономер-димер, быстро разбавляют
(например, в 10 раз) растворителем при той же температуре и наблюдают изменение
со временем оптического поглощения димера в результате сдвига равновесия от
некоторого исходного значения Dо
до равновесного D¥,
соответствующего более разбавленному
раствору;
б)
при использовании метода температурного скачка раствор, содержащий равновесную
смесь димера и мономера, нагревают до 65 – 70оС (при этом димер
практически полностью диссоциирует), а затем быстро охлаждают до заданной температуры
и наблюдают по оптическому поглощению димера за приближением к новому положению
равновесия, соответствующему новой температуре.
Нарисовать
(качественно) вид кинетических кривых для оптического поглощения димера для
каждого из релаксационных методов при температурах 10, 20 и 30оС.
9.
В ряде книг (см., например, Н.Уэйт. Химическая кинетика. М.: Мир, 1974, с.38)
описывается следующий эксперимент по
химической кинетике. Большой газовый шприц наполняют диоксидом азота (он
находится в равновесии с тетроксидом N2O4) и резко
вдвигают поршень, уменьшая объем смеси примерно вдвое. При этом интенсивность
окраски смеси сначала скачком увеличивается, а затем смесь медленно светлеет,
хотя и остается более темной, чем до сжатия. Объясняется этот опыт так. Как
известно, NO2 бурый, а N2O4 бесцветный. Сразу
же после сжатия концентрация всех газов, в том числе и диоксида, из-за
уменьшения объема смеси скачком возрастает, поэтому смесь резко темнеет. Затем
смесь медленно (как показывает эксперимент, иногда в течение нескольких минут)
релаксирует к новому положению равновесия, которое соответствует новому, более
высокому, давлению в системе (по принципу Ле Шателье равновесие должно
смещаться в сторону тетроксида). При этом утверждается, что это –
"эксперимент, демонстрирующий кинетику релаксации к новому положению
равновесия при изменении давления в системе".
Правильно
ли объясняется эксперимент в книге? Действительно ли мы наблюдаем приближение к
новому равновесию, вызванное повышением давления? Рассчитать характеристическое
время приближения системы к равновесию при 20оС, если предэкспонент
для мономолекулярной реакции диссоциации N2O4 равен 1015,3
с–1, а энергия активации этой реакции равна 58 кДж/моль. Какова
истинная причина описанных изменений? (Указание: рассчитать параметры газа
смеси сразу после его сжатия в случае
замены оксидов азота воздухом. Что дает это упрощение?)
10.
В 1930 г. Фаркаш изучал кинетику орто-пара-конверсии водорода. При комнатной
температуре и выше равновесная смесь содержит 75% орто-водорода (почему?).
Фаркаш переводил сжиженный водород в основном в пара-изомер (как это можно
сделать?) и после испарения водорода и его нагрева до 650оС измерял
кинетику релаксации смеси к равновесному при этой температуре составу путем
измерения теплопроводности газа (почему она разная у о- и п-Н2?).
Оказалось, что время полупревращения зависит от давления водорода:
| р /Торр | 50 | 100 | 200 | 400 |
| t1/2 /мин | 10,8 | 7,5 | 5,3 | 3,7 |
Интерполяция имевшихся
в то время литературных данных по константе равновесия диссоциации водорода на
атомы к температуре 650оС дала значение 1,9´10–21
моль/л. Предполагая, что механизм конверсии при 650оС Н + п-Н о-Н2
+ Н, найти константы скорости прямой и обратной реакции.
о-Н2
+ Н, найти константы скорости прямой и обратной реакции.

