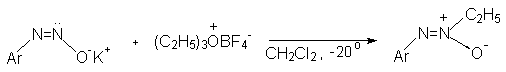III.4. Методы диазотирования.
Диазотирование ароматического амина осуществляется четырьмя основными методами, выбор каждого из которых определяется природой исходного амина.
1. Метод "прямого" диазотирования применим для диазотирования анилина, алкил-, галоген - и алкоксианилинов. Раствор одного эквивалента нитрита натрия при охлаждении до 0 - (+5 о) постепенно добавляют к водному раствору одного эквивалента амина с тремя эквивалентами сильной минеральной кислоты (HСl, H2SO4 ) и др.
2. "Обратный" метод диазотирования используют для плохо растворимых в кислоте аминов, например, сульфаниловой, антраниловой и нафтионовой кислот, для которых характерно образование внутренних солей. В этом случае щелочной раствор диазотируемого амина и нитрита натрия постепенно вводят в водный раствор охлажденной до +5о разбавленной минеральной кислоты ( HCl или H2SO4).
3. Для диазотирования таких нестабильных соединений , как аминофенолы или аминонафтолы, которые легко окисляются азотистой кислотой, реакцию проводят с добавлением солей цинка или меди, препятствующих окислению амина.
4. Для диазотирования слабоосновных аминов, содержащих одну или несколько нитрогрупп, три- или тетрагалогенанилинов (Hal = Cl,Br), амин растворяют в смеси концентрированных H2SO4 - H3PO4 или H2SO4 - CH3COOH и полученный раствор при охлаждении прибавляют к нитрозилсерной кислоте. Следует отметить, что диазотирование полинитроаминов требует соблюдения определенных предосторожностей, так как образующиеся полинитродиазосоединения взрывоопасны.
Этот же метод используют и для диазотирования изомерных о-,м- и п-фенилендиаминов. В этом случае сильнокислая среда позволяет свести к минимуму различные побочные процессы.
Полученный одним из описанных выше методов водный раствор соли диазония сразу используют для получения целевого продукта. Однако прежде чем использовать диазораствор для дальнейших превращений, следует убедиться в полноте протекания диазотирования, т.е. проверить отсутствие в реакционной массе непрореагировавших исходных веществ - амина и азотистой кислоты.
При добавлении к порции раствора диазосоединения ацетата натрия, снижающего кислотность среды, при наличии исходного амина образуется триазен - яркоокрашенный, нерастворимый в воде осадок.
![]()
Азотистую кислоту можно обнаружить с помощью иодкрахмальной бумаги, которая мгновенно синеет от выделяющегося йода при наличии азотистой кислоты. После завершения реакции диазотирования избыток азотистой кислоты, обладающей окислительными свойствами, удаляют добавлением мочевины до прекращения выделения газообразных продуктов из реакционной смеси.
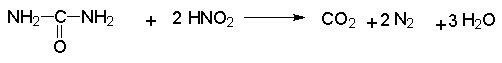
III.5. Равновесия между различными формами диазосоединений.
Катион арендиазония проявляет свойства двухосновной кислоты Льюиса. Согласно принципу ЖМКО он относится к разряду очень мягких кислот Льюиса, для которых константа равновесия реакции
![]()
с мягкими основаниями типа цианид- и сульфит-иона высока (103-105), в то время как с жесткими основаниями OH-, OR- и др. она очень мала. При добавлении щелочи к раствору соли диазония первоначально образуется диазогидроксид ( старое название диазогидрат).
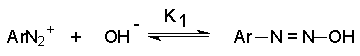
В отличие от катиона диазония, как кислоты Льюиса, диазогидрат является протонной, брендстедовской кислотой, которая быстро взаимодействует с еще одним гидроксид-ионом с образованием диазотат- аниона.
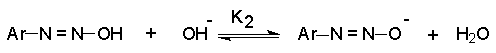
В нейтральном водном растворе эти равновесия могут быть выражены следующим образом :
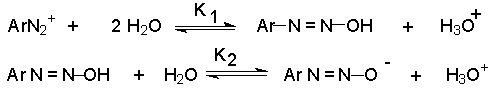
Катион арендиазония представляет собой кислоту Льюиса, тогда как диазогидрат является классической кислотой Бренстеда.
Для обычных многоосновных кислот Бренстеда всегда первая константа диссоциации больше, чем вторая, а вторая больше чем третья. Принимая во внимание то, что катион арендиазония - кислота Льюиса, а диазогидрат -–кислота Бренстеда, приведенная выше закономерность может и не выполняться. Действительно, для приведенных выше констант равновесия К2 >К1.
Значение рК1 для катионов арендиазония изменяется в интервале 11-13, а рК2 для диазогидратов колеблется в интервале 9-10. Поэтому концентрация диазогидрата в водном растворе должна быть очень мала и его трудно зафиксировать обычными спектральными методами, хотя его существование не вызывает сомнения.
Диазотат-анионы подобно другим соединениям с двойной связью азот-азот или углерод-азот. существуют в анти-(транс-) и син-(цис-) формах. При взаимодействии катиона арендиазония со щелочью первоначально образуется менее стабильная син-форма диазотата, которая при стоянии или нагревании в щелочной среде переходит в более стабильную анти-форму.
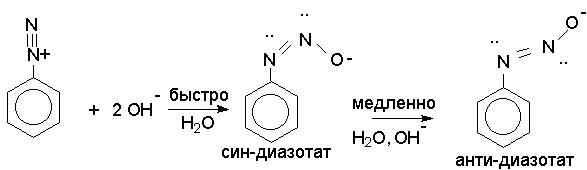
Скорость изомеризации син-диазотата в анти-изомер зависит от природы заместителей в бензольном кольце. Электроноакцепторные заместители облегчают эту изомеризацию и катион пара-нитробензолдиазония или 2,4- динитробензолдиазония при обработке водной щелочью сразу же превращается в анти-диазотат.
Электронодонорные заместители замедляют син-анти-изомеризацию. Для превращения катиона пара-метоксибензолдиазония в анти-диазотат необходимо нагревать раствор диазониевой соли со щелочью.
Диазотат-ионы относятся к амбидентным ионам с двумя независимыми нуклеофильными центрами - кислородом и азотом. При протонировании анти-диазотата образуется только N-нитрозоамин, т.е. амбидентный анти-диазотат-ион протонируется исключительно по атому азота.
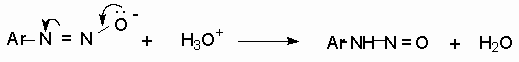
Далее N-нитрозоамин в кислой среде медленно превращается в катион арендиазония, как было уже описано ранее в соответствии со стадиями (2 - 6) при обсуждении механизма диазотирования. Син- диазотаты при протонировании образуют диазогидраты в результате протонирования по кислороду. Диазогидрат далее очень быстро превращается в кислой среде в катион арендиазония.
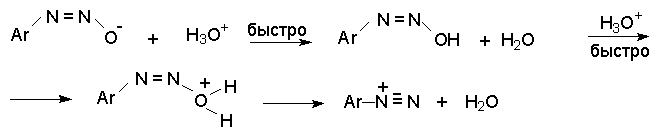
Такое различие в поведении син- и анти- форм диазотат-ионов обусловлено тем, что син-диазотат обладает более высокой основностью по сравнению с анти-диазотатом и протонируется поэтому по атому кислорода. Менее основный анти-диазотат протонируется по атому азота с образованием N- нитрозоамина. Различие в основности двух форм диазотатов хорошо объясняет смещение равновесия в сторону менее основного и, следовательно, более стабильного анти-диазотата при нагревании. Обратная изомеризация в некоторых случаях наблюдается только при УФ облучении.
Общую схему протолитических превращений ароматических диазосоединений в водном растворе можно представить следующим образом (Б.А. Порай-Кошиц, Г.Цоллингер) :
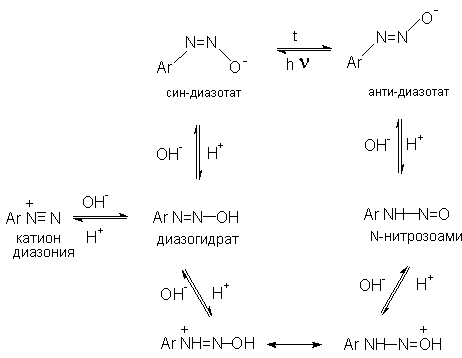
Уместно заметить, что подобную сложную последовательность превращений на основании чисто умозрительных рассуждений предложил А.Ганч еще в 1894 году. В настоящее время она надежно доказана.
Диазотат-ион проявляет свойственную амбидентным ионам двойственную реакционную способность не только при протонировании, но и в реакциях алкилирования. При алкилировании натриевых солей анти-диазотатов мягкими алкилиодидами и алкилбромидами получаются N- алкилнитрозоамины, тогда как с жесткими алкилтозилатами или солями триалкилоксония образуются диазоэфиры.
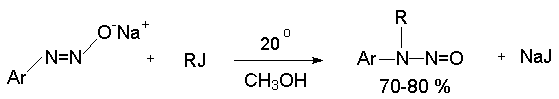
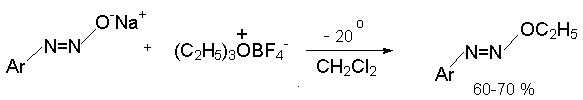
Серебряные соли анти-диазотатов алкилируются только по атому кислорода, что приводит к получению диазоэфиров.
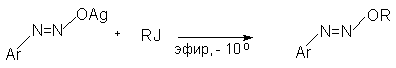
В отличие от этого соли син-диазотатов дают при алкилировании самыми разнообразными алкилирующими агентами транс-азоксисоединения.