Ароматические и алифатические диазосоединения сильно различаются по строению, стабильности и реакционной способности. Наиболее важным классом диазосоединений являются ароматические диазосоединения.
Ароматическими диазосоединениями называются
вещества, в которых один из атомов азота
азогруппы -N=N- связан с ароматическим радикалом, а
другой с гетероатомом. В качестве примера можно
привести фенилдиазоаминобензол C6H5-N=N-NH-C6H5,
фенилоксидиазобензол С6H5-N=N-OC6H5.
Наиболее важным представителем ароматических
диазосоединений являются арендиазониевые соли ![]() . Соли
арендиазония, где Х - анион сильной кислоты Cl -
,Br - ,HSO4- или комплексный анион :
BF4 - ,SnCl6 2- , PF6 -,
SbF6 - , HgCl3 - и т.д.
представляют собой типичные ионные
кристаллические вещества, растворимость которых
в воде и спиртах определяется главным образом
природой аниона Х- В воде обычно хорошо
растворимы галогениды и сульфаты арилдиазония,
соли же с комплексным анионом характеризуются
низкой растворимостью.
. Соли
арендиазония, где Х - анион сильной кислоты Cl -
,Br - ,HSO4- или комплексный анион :
BF4 - ,SnCl6 2- , PF6 -,
SbF6 - , HgCl3 - и т.д.
представляют собой типичные ионные
кристаллические вещества, растворимость которых
в воде и спиртах определяется главным образом
природой аниона Х- В воде обычно хорошо
растворимы галогениды и сульфаты арилдиазония,
соли же с комплексным анионом характеризуются
низкой растворимостью.
III.1. Строение солей арендиазония.
Согласно данным рентгеноструктурного анализа
в катионе арендиазония два атома азота
расположены линейно в плоскости ароматического
кольца. Спектральные и рентгеноструктурные
исследования свидетельствуют о наличии тройной
связи азот-азот в солях диазония ![]() . В катионе
арендиазония оба атома азота несут
положительный заряд. Положительный заряд на
концевом атоме азота всего в 2 раза ниже, чему
центрального атома азота, формально несущего
положительный заряд.
. В катионе
арендиазония оба атома азота несут
положительный заряд. Положительный заряд на
концевом атоме азота всего в 2 раза ниже, чему
центрального атома азота, формально несущего
положительный заряд.
Диазогруппа ![]() относится к сильнейшим
электроноакцепторным заместителям и
значительно превосходит нитрогруппу по своим
акцепторным свойствам. Сопряжением
пи-электронов ароматического кольца с
диазогруппой обусловлена более высокая
стабильность катионов
относится к сильнейшим
электроноакцепторным заместителям и
значительно превосходит нитрогруппу по своим
акцепторным свойствам. Сопряжением
пи-электронов ароматического кольца с
диазогруппой обусловлена более высокая
стабильность катионов ![]() по сравнению с катионами
по сравнению с катионами ![]() , которые
даже при -100о мгновенно разлагаются с
выделением азота и образованием чрезвычайно
активного карбокатиона Alk+. Относительная
стабильность ароматических солей диазония в
большой степени зависит от природы противоиона и
заместителей в бензольном кольце. Соли с
комплексным анионом BF4- ,SbF6-
, HgCl3 - намного стабильнее растворимых
в воде галогенидов и сульфатов диазония и могут
иногда сохраняться в твердом виде на воздухе при
20о в течение нескольких недель. Сухие
галогениды диазония, напротив, очень неустойчивы
и взрывчаты, поэтому их никогда не выделяют из
раствора в индивидуальном виде.
, которые
даже при -100о мгновенно разлагаются с
выделением азота и образованием чрезвычайно
активного карбокатиона Alk+. Относительная
стабильность ароматических солей диазония в
большой степени зависит от природы противоиона и
заместителей в бензольном кольце. Соли с
комплексным анионом BF4- ,SbF6-
, HgCl3 - намного стабильнее растворимых
в воде галогенидов и сульфатов диазония и могут
иногда сохраняться в твердом виде на воздухе при
20о в течение нескольких недель. Сухие
галогениды диазония, напротив, очень неустойчивы
и взрывчаты, поэтому их никогда не выделяют из
раствора в индивидуальном виде.
III.2. Диазотирование первичных ароматических аминов.
Соли арендиазония образуются при взаимодействии первичных ароматических аминов с азотистой кислотой. Эта реакция была открыта в 1858 году П.Гриссом и приобрела огромное значение в синтезе ароматических соединений самых разнообразных классов. В промышленности соли арендиазония нашли широкое применение для получения разнообразных азокрасителей всех цветов и оттенков. По этой причине диазотирование относится к числу важнейших и наиболее изученных реакций в органической химии.
Диазотирование первичных ароматических аминов описывается следующим суммарным уравнением :
ArNH2 + NaNO2 + 2 HCl![]() ArN+=N Cl - + NaCl + 2 H2O
ArN+=N Cl - + NaCl + 2 H2O
Согласно приведенному уравнению для диазотирования требуется два эквивалента соляной кислоты. Фактически же соляную, серную или другую сильную минеральную кислоту берут в количестве более трех эквивалентов для того чтобы по окончании диазотирования рН не превышало 0,5-1,5.
Высокая кислотность среды необходима для того, чтобы подавить две побочные реакции с участием образующегося катиона арендиазония и исходного ароматического амина. В одной из них из диазокатиона и амина получается диазоаминосоединение, часто называемое триазеном, а в другой аминоазосоединение.
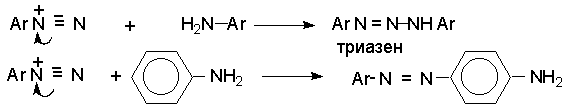
В растворе с низким значением рН резко снижается концентрация свободного амина и тем самым подавляются оба этих нежелательных процесса. Диазотирование - экзотермическая реакция, сопровождающаяся выделением большого количества тепла, а соли арендиазония термически малоустойчивы. Поэтому диазотирование, как правило, проводят при охлаждении, поддерживая температуру в интервале 0-5о .
III.3. Механизм диазотирования.
Исследование механизма диазотирования было начато в конце прошлого века Е.Бамбергером и А. Ганчем и завершилось исчерпывающими исследованиями К.Ингольда (Англия), Г. Цоллингера (Швейцария) и Б.А.Порай-Кошица (СССР).
Рассмотрим в первую очередь вопрос о природе электрофильного агента диазотирования. В водном растворе сильной неорганической кислоты азотистая кислота частично протонируется с образованием нитрозацидий-катиона :
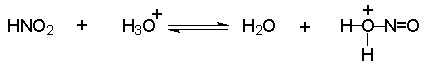
Нитрозацидий-катион очень активный электрофильный агент. Согласно кинетическим данным, этот катион в водном растворе гораздо быстрее реагирует с неорганическими анионами, присутствующими в растворе, чем с ароматическим амином.
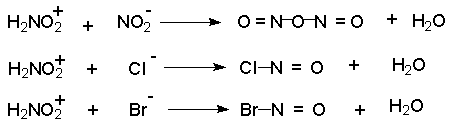
В результате образуются новые реагенты : азотистый ангидрид, хлористый или бромистый нитрозил, которые могут быть электрофильными агентами при диазотировании в разбавленном водном растворе.
В разбавленном водном растворе серной, фосфорной, хлорной и других кислот нитрозирующим агентом является азотистый ангидрид N2O3 . При диазотировании в растворе соляной или бромистоводородной кислоты электрофильным агентом оказывается хлористый и, соответственно, бромистый нитрозил. Сама азотистая кислота представляет собой слишком слабый электрофильный агент для диазотирования ароматических аминов. В сильно кислотной среде активной частицей является, вероятно, катион H2NO2+. Наиболее активный нитрозирующий агент - нитрозилсерная кислота получается только в концентрированной серной кислоте при взаимодействии с нитритом натрия.
2 H2SO4 + NaNO2 --- O=N- OSO3H + NaHSO4 + H2O
Активность электрофильных агентов при диазотировании уменьшается в ряду :
![]()
Эти выводы хорошо согласуются с экспериментальными данными. Диазотирование в водном растворе соляной кислоты идет быстрее, чем в водном растворе серной кислоты, поскольку нитрозилхлорид более сильный электрофильный агент по сравнению с азотистым ангидридом. В свою очередь дизотирование в растворе бромистоводородной кислоты или при добавках бромид-иона идет с большей скоростью, чем в соляной кислоте.
Диазотирование всегда проводят в кислой среде, где протолитическое равновесие сильно смещено вправо.
![]()
Тем не менее диазотированию подвергается амин в виде свобoдного основания. Лимитирующей стадией всего процесса диазотирования является образование N-арилнитрозоаммония, как это предполагал Е. Бамбергер еще в 1900 году, далее следует ряд быстрых протолитических равновесий, приводящих к диазосоединению, как к конечному продукту.
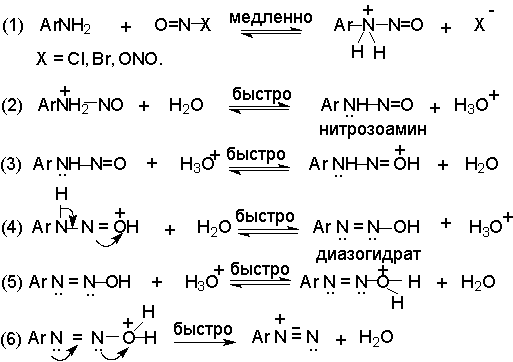
На стадии (4) происходит отщепление протона от
азота или кислорода, поскольку исходный катион
формально является аналогом аллильного катиона.
Депротонирование кислорода приводит к исходному
субстрату - нитрозамину, тогда как
депротонирование азота ведет к образованию
конечного продукта - соли арендиазония. Соли
диазония, как уже было отмечено, редко выделяют
из раствора в индивидуальном виде и в
большинстве случаев сразу же вводят в дальнейшие
превращения. Тем не менее многие соли
арендиазония с некоторыми противоионами ( PF6-,
SbF6-, BF4-) нерастворим в
воде и достаточно стабильны при хранении их в
сухом виде в течение длительного времени. Такие
соли называют стабильными формами
диазосоединений или диазосолями. К ним относятся
соли ![]() X-
= PF6-, BF4-, ZnCl42- ,
SnCl62- и др. С сульфит- и цианид-ионами
катионы жиазония образуют относительно
стабильные ковалентные соединения сульфонаты Ar-
N=N-SO3-Na+ и цианиды Ar-N=N-CN.
X-
= PF6-, BF4-, ZnCl42- ,
SnCl62- и др. С сульфит- и цианид-ионами
катионы жиазония образуют относительно
стабильные ковалентные соединения сульфонаты Ar-
N=N-SO3-Na+ и цианиды Ar-N=N-CN.