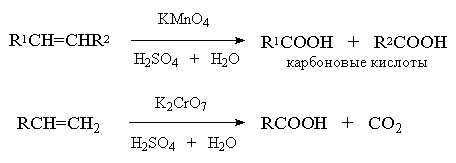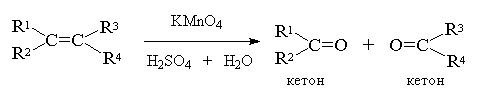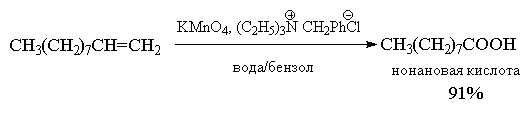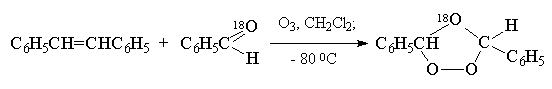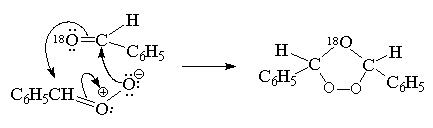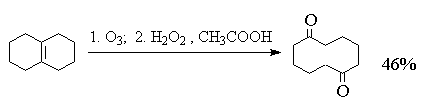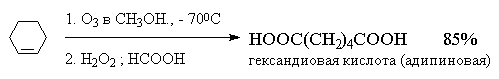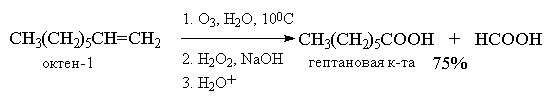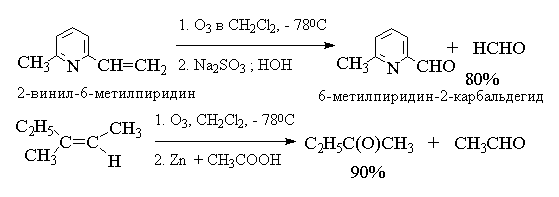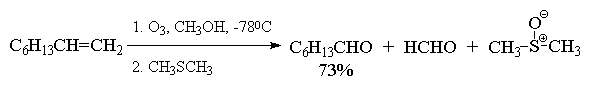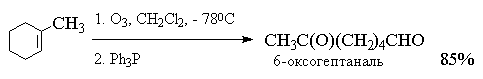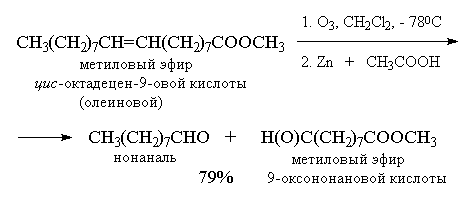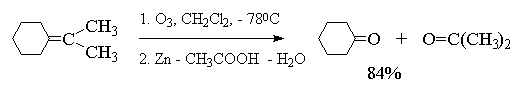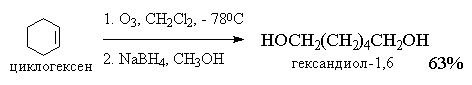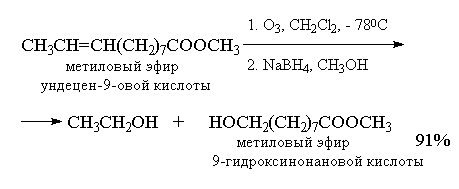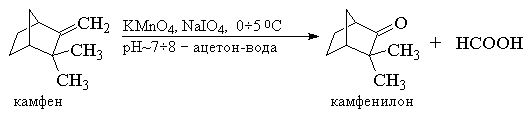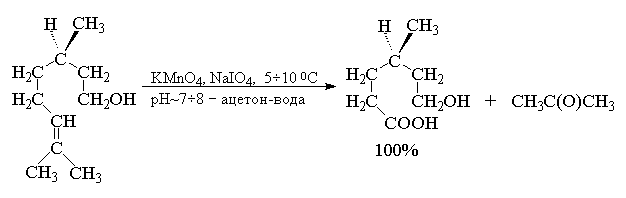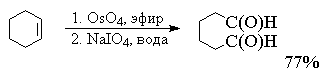|
4.5.б. Окислительное расщепление алкенов
При окислении алкенов щелочным водным
раствором перманганата калия при нагревании или
раствором KMnO4 в водной серной кислоте, а
также при окислении алкенов раствором оксида
хрома (VI) CrO3 в уксусной кислоте или
дихроматом калия и серной кислотой
первоначально образующийся гликоль
подвергается окислительной деструкции. Конечным
результатом является расщепление углеродного
скелета по месту двойной связи и образование в
качестве конечных продуктов кетонов и (или)
карбоновых кислот в зависимости от заместителей
при двойной связи. Если оба атома углерода при
двойной связи содержат только по одной алкильной
группе, конечным продуктом исчерпывающего
окисления будет смесь карбоновых кислот,
тетразамещенный при двойной связи алкен
окисляется до двух кетонов. Однозамещанные
алкены с концевой двойной связью расщепляются до
карбоновой кислоты и углекислого газа.
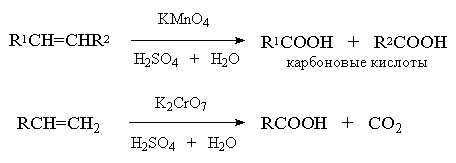
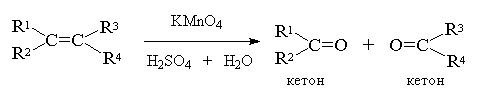
Из-за невысоких выходов карбоновых кислот и
кетонов, реакции исчерпывающего окисления
алкенов в классическом варианте не нашли
широкого применения и ранее использовались, в
основном, для установления строения исходного
алкена по продуктам деструктивного окисления. В
настоящее время окисление алкенов (R-CH=CH-R и R-CH=CH2)
до карбоновых кислот (RCOOH) с помощью перманганата
или дихромата калия проводят в условиях
межфазного катализа. Выходы карбоновых кислот
при этом превышают 90%.
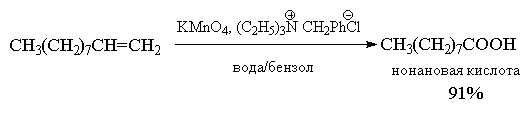
4.5.в. Озонолиз алкенов
Реакция алкенов с озоном является наиболее
важным методом окислительного расщепления
алкенов по двойной связи. В течение многих
десятилетий эта реакция служила основным
методом определения строения исходного
углеводорода, а также находила применение в
синтезе разнообразных карбонильных соединений.
Реакция алкена с озоном проводится пропусканием
тока ~5%-ной смеси озона и кислорода в раствор
алкена в хлористом метилене или этилацетате при
-800  -1000С.
Окончание реакции контролируется пробой на
свободный озон с иодидом калия. Механизм этой
своеобразной и сложной реакции установлен
главным образом благодаря работам Р Криге.
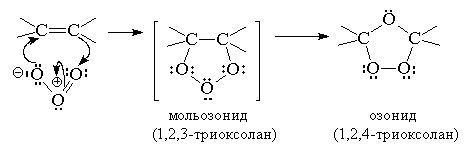
Первым продуктом 1,3-диполярного
циклоприсоединения к двойной связи является так
называемый мольозонид (1,2,3-триоксолан). Этот
аддукт нестабилен и далее самопроизвольно
разлагается с раскрытием цикла и образованием в
качестве конечного продукта нормального озонида
(1,2,4-триоксолана). -1000С.
Окончание реакции контролируется пробой на
свободный озон с иодидом калия. Механизм этой
своеобразной и сложной реакции установлен
главным образом благодаря работам Р Криге.
Первым продуктом 1,3-диполярного
циклоприсоединения к двойной связи является так
называемый мольозонид (1,2,3-триоксолан). Этот
аддукт нестабилен и далее самопроизвольно
разлагается с раскрытием цикла и образованием в
качестве конечного продукта нормального озонида
(1,2,4-триоксолана).
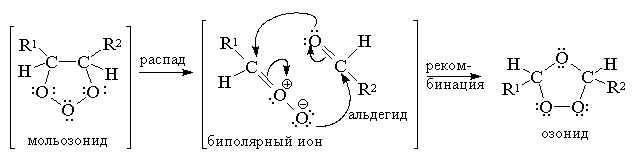
В настоящее время общепризнано, что
превращение мольозонида в обычный озонид
происходит по механизму расщепления -
рекомбинации. Мольозонид претерпевает
самопроизвольное раскрытие нестабильного
1,2,3-триоксоланового цикла с образованием
карбонильного соединения и биполярного иона,
которые далее реагируют между собой также по
схеме 1,3-диполярного циклоприсоединения.
Приведенная схема перегруппировки мольозонида
в нормальный озонид подтверждается тем, что если
до полного образования озонида в реакционной
смеси присутствует в качестве
"перехватчика" биполярного иона другое
карбонильное соединение, то образуется так
называемый "смешанный озонид". Так,
например, при озонилизе цис-стильбена в
присутствии бензальдегида, меченного изотопом 18О,
метка входит в состав эфирного, а не перекисного
мостика озонида:
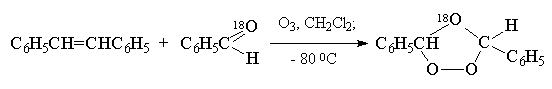
Этот результат хорошо согласуется с
образованием смешанного озонида при
рекомбинации биполярного иона с меченным
бензальдегидом:
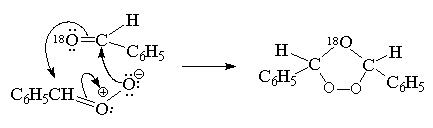
Озониды представляют собой очень нестабильные
соединения, разлагающиеся со взрывом. Их не
выделяют в индивидуальном виде, а расщепляют при
действии самых разнообразных регентов. Следует
различать восстановительное и окислительное
расщепление. При гидролизе озониды медленно
расщепляются на карбонильные соединения и
перекись водорода. Перекись водорода окисляет
альдегиды до карбоновых кислот. Это так
называемое окислительное разложение озонидов:
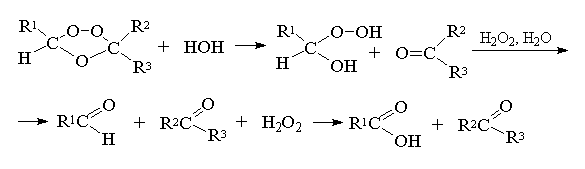
Таким образом, при окислительном разложении
озонидов образуются карбоновые кислоты и (или)
кетоны в зависимости от строения исходного
алкена. В качестве окислителей можно
использовать кислород воздуха, перекись
водорода, перкислоты или гидроокись серебра.
Наиболее часто в синтетической практике для этой
цели используют перекись водорода в уксусной или
муравьиной кислоте, а также перекись водорода в
щелочной среде.
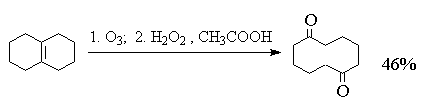
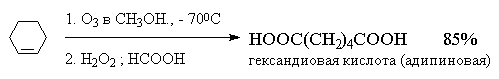
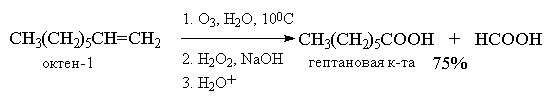
На практике метод окислительного разложения
озонидов используется, в основном, для получения
карбоновых кислот.
Более важное значение имеет восстановительное
расщепление озонидов. В качестве
восстановителей наиболее часто используются
цинк и уксусная кислота, трифенилфосфин или
диметилсульфид. В этом случае конечными
продуктами озонолиза оказываются альдегиды или
кетоны в зависимости от строения исходного
алкена.
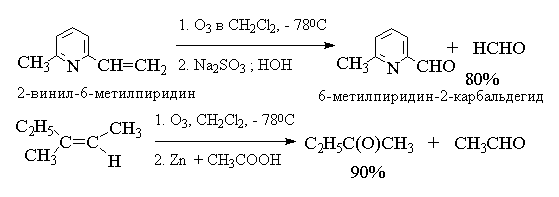
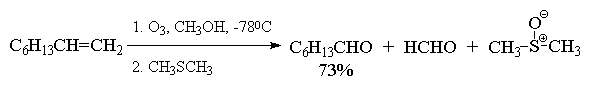
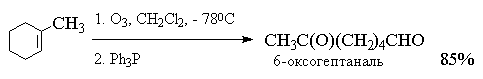
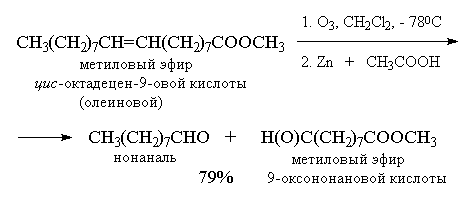
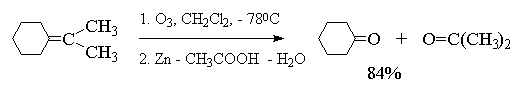
Из приведенных выше примеров видно, что
тетразамещенный при двойной связи алкен при
озонолизе и последующем восстановительном
разложении озонида образует два кетона, тогда
как тризамещенный алкен дает кетон и альдегид.
Дизамещенный симметричный алкен при озонолизе
образует два альдегида, а алкены с концевой
связью - альдегид и формальдегид.
Интересной модификацией озонолиза является
метод, где в качестве восстановителя озонида
используется боргидрид натрия, В этом случае
конечными продуктами реакции оказываются
первичные или вторичные спирты, образующиеся при
восстановлении соответственно альдегидов и
кстонов.
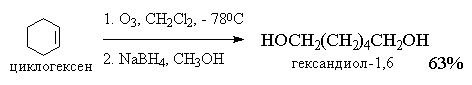
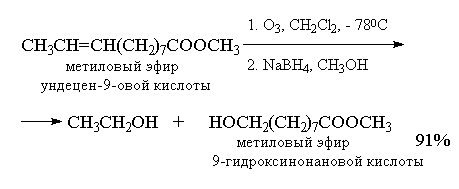
Озонолиз алкенов - это сложный, трудоемкий и
взрывоопасный процесс, требующий применения
специальной аппаратуры. По этой причине были
разработаны другие методы окислительного
расщепления алкенов до карбонильных соединений
и карбоновых кислот, которые с успехом заменяют
реакцию озонолиза в синтетической практике.
Один из современных препаративных методов
окислительной деструкции алкенов был предложен
в 1955 г Р. Лемье. В основе этого метода лежит
гидроксилирование алкенов с помощью
перманганата калия с последующим расщеплением
вицинального гликоля периодатом натрия NaIO4
при рН ~ 7 8. Периодат сам по
себе не взаимодействует с алкеном. Продуктами
этого двухстадийного окислительного
расщепления являются кетоны или карбоновые
кислоты, поскольку альдегиды в этих условиях
также окисляются до карбоновых кислот. В методе
Лемье не возникает трудоемкой проблемы
отделения одного из продуктов реакции, - двуокиси
марганца, так как и двуокись, и манганат вновь
окисляются периодатом до перманганат-иона. Это
позволяет использовать только каталитические
количества перманганата калия. Ниже приведены
некоторые типичные примеры окислительного
расщепления алкенов по методу Лемье. 8. Периодат сам по
себе не взаимодействует с алкеном. Продуктами
этого двухстадийного окислительного
расщепления являются кетоны или карбоновые
кислоты, поскольку альдегиды в этих условиях
также окисляются до карбоновых кислот. В методе
Лемье не возникает трудоемкой проблемы
отделения одного из продуктов реакции, - двуокиси
марганца, так как и двуокись, и манганат вновь
окисляются периодатом до перманганат-иона. Это
позволяет использовать только каталитические
количества перманганата калия. Ниже приведены
некоторые типичные примеры окислительного
расщепления алкенов по методу Лемье.

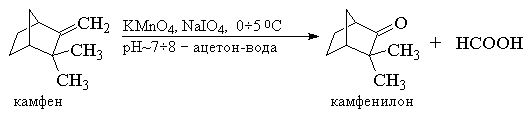
Цитронеллол - спирт, входящий в состав розового
масла, масла герани и лимона, - окисляется смесью
перманганата калия и периодата натрия в водном
ацетоне при 5 10 0С до
6-гидрокси-4-метилгексанкарбоновой кислоты с
количественным выходом. 10 0С до
6-гидрокси-4-метилгексанкарбоновой кислоты с
количественным выходом.
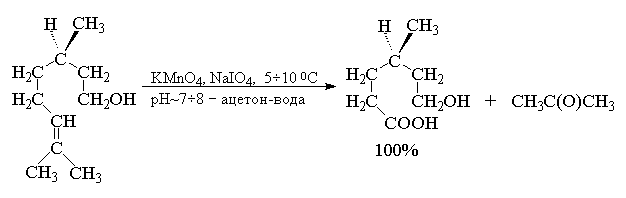
В другой разновидности этого метода вместо
перманганата калия используют каталитические
количества тетраоксида осмия (Лемье, Джонсон 1956
г). Особое достоинство комбинации OsO4 и NaIO4
заключается в том, что она позволяет остановить
окисление на стадии альдегида. Тетраоксид осмия
присоединяется к двойной связи алкена с
образованием осмата, который окисляется
периодатом натрия до карбонильных соединений с
регенерацией четырехокиси осмия.
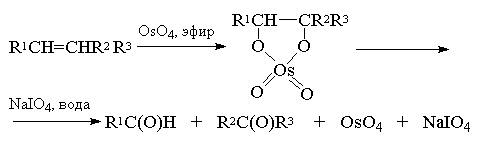
Вместо тетраоксида осмия можно использовать и
тетраоксид рутения RuO4. Окислительная
деструкция алкенов по Лемье-Джонсону приводит к
тем же продуктам, что и озонолиз с
восстановительным расщеплением озонидов.
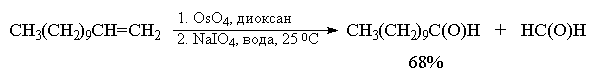 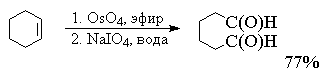
В терминах, характерных для современной
органической химии, это означает, что комбинация
OsO4-NaIO4 представляет собой синтетический
эквивалент реакции озонолиза алкенов с
последующим восстановительным расщеплением.
Аналогично, окисление алкенов смесью
перманганата и периодата - это синтетический
эквивалент озонолиза с окислительным
разложением озонидов.
Таким образом, окисление алкенов - это не только
совокупность препаративных методов получения
спиртов, эпоксидов, диолов, альдегидов, кетонов и
карбоновых кислот, это также один из возможных
путей установления структуры исходного алкена.
Так, по результату, окислительной деструкции
алкена можно определить положение двойной связи
в молекуле, тогда как стереохимический результат
син- или анти-гидроксилирования алкена
позволяет сделать вывод о его геометрии.
|