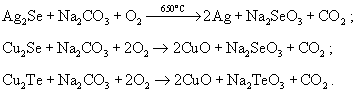|
Кафедра неорганической химии
Учебные материалы по неорганической химии
[предыдущий раздел] [содержание]
[следующий раздел]
§ 3. Химические свойства халькогенов.
Сера - химически активное вещество, особенно
при повышенных температурах, облегчающих разрыв
связей S- S. Она непосредственно соединяется с
многими простыми веществами, за исключением
инертных газов, N, Te, I, Pt, Au. Однако соединения серы
с азотом, теллуром, иодом, платиной и золотом
синтезированы косвенными методами.
Сера медленно реагирует с Н2 при 120оС
и значительно быстрее при температуре выше 200оС,
образуя Н2S, сгорает во фторе с образованием
SF6. Реакция серы с хлором сильно ускоряется
при нагревании: ее продуктами являются S2Cl2
и SCl2. Во влажном
воздухе сера медленно окисляется, на воздухе
при 250-260оС сгорает до SО2.
Реакционная способность серы определяется
особенностью строения и прочностью связи S- S в
молекулах Sn. Циклические молекулы S8 в
твердой сере менее активны, чем бирадикальные
цепочки S8, образующиеся в расплаве (см. § 2.4).
Получаемая фотолизом паров атомарная сера
отличается очень высокой реакционной
способностью.
Как и у молекулярного кислорода (см. § 2.2), у
молекулярной серы возможны два электронных
состояния: триплетное и синглетное с разными
химическими активностями.
Основное триплетное состояние с двумя
неспаренными электронами лежит на 110.52 кДж/моль
ниже возбужденного синглетного состояния без
неспаренных электронов. Например, парафиновые
углеводороды инертны к триплетной сере, но в
присутствии синглетной серы образуют
меркаптаны: RH + S  RSH. RSH.
Se, Te и Po соединяются непосредственно с
большинством простых веществ, хотя и труднее, чем
О и S. Среди их соединений наиболее устойчивы селениды,
теллуриды и полониды металлов, но их
устойчивость ниже, чем у аналогичных оксидов и
сульфидов.
С сильно электроотрицательными элементами (F, O
и Cl) халькогены проявляют положительные степени
окисления +2, +4 и +6.
Как и элементы VII группы, халькогены
диспропорционируют в воде:
2/n Эn + Н2О  Н2Э + Н2ЭО3. Н2Э + Н2ЭО3.
Равновесие существенно смещается в сторону
продуктов реакции при кипячении и в присутствии
щелочей:
3Э + 6NaOH  2Na2Э + Na2ЭО3
+ 3Н2О. 2Na2Э + Na2ЭО3
+ 3Н2О.
[предыдущий раздел] [содержание] [следующий
раздел]
§ 4. Халькогены в природе. Получение
простых веществ.
В природе халькогены сосредоточены в рудных
месторождениях, где они связаны преимущественно
с металлами. Значительная часть серы находится
либо в самородном состоянии (вулканическая сера),
либо в форме сульфидов и сульфатов (CuFeS2 - халькопирит,
ZnS - сфалерит, FeAsS - арсенит, CaSO4. 2H2O
- гипс, Na2SO4. 10Н2О - мирабилит).
Большие месторождения самородной серы находятся
в США, в России они расположены в районе
Самарской Луки на Волге. Огромное количество
серы содержится в нефти и в нефтяных газах,
откуда их извлекают в процессе технологической
очистки. Присутствие соединений серы в нефти
создает экологические и технологические
проблемы. Например, в газовых месторождениях
около Астрахани содержание Н2S достигает
десятков процентов. Без глубокой очистки такие
газы нельзя сжигать из-за химического отравления
природы сернистым газом и нельзя перекачивать
из-за сероводородной коррозии трубопроводов,
скорость которой достигает нескольких мм в год.
Из подземных месторождений серу извлекают,
расплавляя ее перегретой водой (165оС) и
выдавливая из-под земли сжатым воздухом. Расплав
перекачивают в емкости или распыляют в воду для
получения тонкого порошка. При этом получают
продукт чистотой 99.5-99.9% без примесей Se, Te и As.
Серу из сероводорода получают процессом
Клауса. Около 1/3 объема извлеченного из нефти H2S
сжигают до SO2, H2O и паров серы:
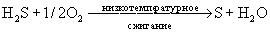 (Аналогичный
процесс происходит при попадании воды в кратеры
вулканов, а также в глубине Земли в результате
деятельности микроорганизмов) (Аналогичный
процесс происходит при попадании воды в кратеры
вулканов, а также в глубине Земли в результате
деятельности микроорганизмов)

Затем остальную часть H2S в присутствии
оксидных катализаторов (Fe2O3, AlO3)
подвергают взаимодействию с SO2:
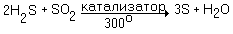
Основным источником Se и Te служит шлам после
электролитической очистки меди, который
содержит значительные количества Ag, Au и
платиновых металлов. Шлам подвергают
окислительному обжигу с содой:
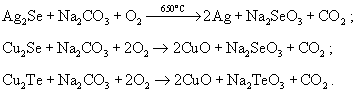
При отсутствии соды происходит улетучивание SeO2:
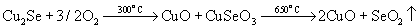
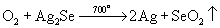
Разделение Se и Te достигается обработкой серной
кислотой:
Na2SeO3 + Na2TeO3 + H2SO4
  TeO2. nH2O + H2SеO3
+ 2Na2SO4 . TeO2. nH2O + H2SеO3
+ 2Na2SO4 .
Теллур осаждается в виде гидратированного
диоксида, H2SeO3 остается в растворе. Из
этого раствора действием SO2 осаждают
красный Se чистотой 99.5%:
H2SeO3 + 2SO2 + H2O   Se + 2H2SO4 . Se + 2H2SO4 .
Гидратированный ТеО2 растворяют в щелочи
и подвергают электролитическому восстановлению
до Те:

Металлический Ро получают термическим
разложением в вакууме сульфида полония (275оС)
или диоксида РоО2 (~500оС) с последующей
возгонкой металла. Также можно его получать
восстановлением РоО2 водородом (200оС)
или РоBr2 сухим аммиаком:
3PoBr2 + 2NH3  3Po + N2 + 6HBr 3Po + N2 + 6HBr
[предыдущий раздел] [содержание] [следующий
раздел]
§ 5. Строение молекулы Н2Э .
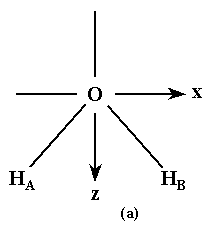
Рис.3. Схема расположения координатных осей (а) и
энергетическая диаграмма орбиталей молекулы Н2О
(б).
Строение молекул гидридов халькогенов Н2Э
можно проанализировать с помощью метода
молекулярных орбиталей (МО). В качестве примера
рассмотрим схему молекулярных орбиталей
молекулы воды (рис.3)
Для построения (Подробнее см. Г.Грей
"Электроны и химическая связь",М., изд-во
"Мир", 1967, с.155-62 и G.L.Miessier, D.A.Tarr, "Inorganic
Chemistry", Prantice Hall Int.Inc., 1991, p.153-57) схемы МО молекулы
Н2О совместим начало координат с атомом
кислорода, а атомы водорода расположим в
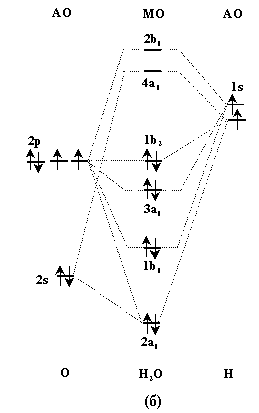
плоскости xz (рис.3). Перекрывание 2s- и 2p-АО
кислорода с 1s-АО водорода показано на рис.4. В
формировании МО принимают участие АО водорода и
кислорода, обладающие одинаковой симметрией и
близкими энергиями. Однако вклад АО в
образование МО разный, что отражается в разных
величинах коэффициентов в соответствующих
линейных комбинациях АО. Взаимодействие
(перекрывание) 1s-АО водорода, 2s- и 2рz-АО
кислорода приводит к образованию 2a1-связывающей
и 4a1-разрыхляющей МО.
Рис.4. Перекрывание 2s- (а), 2px- (б) и 2pя-
(в)орбиталей атома кислорода с 1s-орбиталями двух
атомов водорода молекулы воды.
c1 (2so) + c2 (2so) + c2 (2pz,o) + c3 (2pz,o) + c3 (1sн) = (1sн) =  МО(2a1) МО(2a1)
c4 (2so) + с5 (2so) + с5 (1sн) -с6 (1sн) -с6 (2pz,o) = (2pz,o) =  МО(4a1) . МО(4a1) .
При этом в энергию связывающей МО увеличенный
вклад вносит АО с более низкой энергией, а в
энергию разрыхляющей МО - атомная орбиталь с
более высокой энергией. С учетом этого с1>>c2,
а с5>c4 и с6. При перекрывании 2рх-АО
кислорода и 1s-АО водорода образуются 1b1-связывающая
и 2 b1-разрыхляющая МО:
с7 (2рх,о)
+ с8 (2рх,о)
+ с8 (1sн) = (1sн) =  МО(1b1) (с7>>c8) МО(1b1) (с7>>c8)
с9 (2рх,о)
- с10 (2рх,о)
- с10 (1sн) = (1sн) =  МО(2b1) (с9>>c10). МО(2b1) (с9>>c10).
2рz-АО кислорода и 1s-АО водорода образуют
также 3a1 - практически несвязывающую МО.
с11 (2pz) +
с12 (2pz) +
с12 (1sн) = (1sн) =  МО(3a1) , МО(3a1) ,
так как с11>>c12 (рис.4в) из-за
слабого перекрывания атомных орбиталей.  -орбиталь кислорода
расположена перпендикулярно плоскости xz, по
условиям симметрии не перекрывается с
1s-орбиталями атома водорода и поэтому дает 1b2
несвязывающую орбиталь (рис.3б). -орбиталь кислорода
расположена перпендикулярно плоскости xz, по
условиям симметрии не перекрывается с
1s-орбиталями атома водорода и поэтому дает 1b2
несвязывающую орбиталь (рис.3б).
Взаимодействие 4-х атомных орбиталей кислорода
(2s-, 2рх-,  , 2pz)
и двух 1s-орбиталей атомов водорода приводит к
образованию шести молекулярных орбиталей: двух
связывающих (2а1 и 1b1), двух
несвязывающих (3а1 и 1b2) и двух
разрыхляющих (4а1 и 2b1). 8 электронов
атомов водорода и кислорода размещаются попарно
на двух связывающих и двух несвязывающих
орбиталях. Из схемы, изображенной на рис.3б, можно
сделать следующие выводы. , 2pz)
и двух 1s-орбиталей атомов водорода приводит к
образованию шести молекулярных орбиталей: двух
связывающих (2а1 и 1b1), двух
несвязывающих (3а1 и 1b2) и двух
разрыхляющих (4а1 и 2b1). 8 электронов
атомов водорода и кислорода размещаются попарно
на двух связывающих и двух несвязывающих
орбиталях. Из схемы, изображенной на рис.3б, можно
сделать следующие выводы.
- Молекулы Н2О, как и молекулы других
гидридов халькогенов, диамагнитны.
- Электроны на связывающих 2а1 и 1b1
орбиталях обеспечивают связи О- Н, а на
несвязывающих (3а1 и 1b2) орбиталях
соответствуют свободным электронным парам в
молекуле Н2О, как это описывается в рамках
метода валентных связей.
- Принципиальным отличием ММО от МВС
является разная энергия ионизации занятых
молекулярных орбиталей, составляющая (в эВ) 27.3 (2а1),
16.2 (1b1), 14.5 (3а1) и 12.6 (1b2),
соответственно.
- ММО (в отличие от МВС) позволяет оценить
разницу в энергиях молекулярных орбиталей: ev (E). В
частности, существенным является различие в
энергии двух несвязывающих орбиталей 3а1 и
1b2. Это связано с различной природой
орбиталей - 1b2 локализована на атоме
кислорода, тогда как 3а1 образована с
участием АО водорода и кислорода и не является
локализованной. Локализация электронов на 1b2 МО
приводит к тому, что отрицательный заряд в
молекуле Н2О сосредоточен вблизи атома
кислорода, а положительный - вблизи атомов
водорода. Таким образом, молекула Н2О
оказывается полярной (дипольный момент
 = l. q = 1.84D,
табл.5). Это соответствует и простым соображениям
электроотрицательности: связывающие электроны
смещаются к более электроотрицательному атому. = l. q = 1.84D,
табл.5). Это соответствует и простым соображениям
электроотрицательности: связывающие электроны
смещаются к более электроотрицательному атому.
Так как у молекулы Н2О в образовании
связей принимают в основном участие 2р-орбитали
кислорода и 1s-орбитали водорода, то можно
ожидать, что угол Н- О- Н должен быть близким к 90о.
Однако из эксперимента следует, что этот угол
равен 104.5о (табл.5). Причина такого различия
заключается в том, что этот угол соответствует
минимуму энергии. Согласно
квантово-механическим расчетам, энергия
молекулы зависит не только от энергии
молекулярных орбиталей и числа электронов на
них, но и от валентного угла Н- О- Н. В приближении
МВС увеличение угла Н- О- Н от 90о
(характерного для взаимодействия р-орбиталей) до
104.5о связано с взаимным отталкиванием
положительно заряженных атомов водорода.
При переходе от Н2О к Н2S, H2Se и H2Te
диаграммы МО изменяются, что обусловлено
увеличением энергий исходных АО халькогенов: Е3s
= -20.7 эВ; Е3р = -12.0 эВ; Е4s = 20.8 эВ; Е4р
= 11.9 эВ. Поэтому растет участие ns-атомных
орбиталей халькогена в образовании молекулярных
орбиталей. При этом несвязывающий характер
орбиталей nb2 сохраняется, а связывающий
характер орбиталей 2а1 усиливается. В целом,
по мере увеличения энергии атомных орбиталей ns- и
nр- уменьшается разность сумм энергий
молекулярных и атомных орбиталей, которые
характеризуют прочность молекул Н2Э.
Вклады nр-АО атомов халькогенов в энергию МО
уменьшаются, и соответственно понижается
локализация электронов на атомах халькогенов и
полярность молекул. Вероятно, благодаря этому
уменьшаются валентные углы Н- Э- Н в молекулах.
Именно так, с точки зрения теории МО ЛКАО,
объясняется понижение устойчивости молекул H2S,
H2Sе, H2Te по сравнению с молекулой Н2О.
[предыдущий раздел] [содержание] [следующий
раздел]
|