


Гормоны. Гидрофильные гормоны
Вторичные мессенджеры
 Вторичные мессенджеры, или посредники,
это внутриклеточные вещества, концентрация которых строго контролируется
гормонами, нейромедиаторами и другими внеклеточными сигналами (см. с. 372).
Такие вещества образуются из доступных субстратов и имеют короткий биохимический
полупериод. Наиболее важными вторичными мессенджерами являются цАМФ
(сAMP), цГТФ (cGTP), Са2+, инозит-1,4,5-трифосфат
[ИФ3 (lnsP3)], диацилглицерин [ДАГ (DAG)] и
монооксид азота (NO).
Вторичные мессенджеры, или посредники,
это внутриклеточные вещества, концентрация которых строго контролируется
гормонами, нейромедиаторами и другими внеклеточными сигналами (см. с. 372).
Такие вещества образуются из доступных субстратов и имеют короткий биохимический
полупериод. Наиболее важными вторичными мессенджерами являются цАМФ
(сAMP), цГТФ (cGTP), Са2+, инозит-1,4,5-трифосфат
[ИФ3 (lnsP3)], диацилглицерин [ДАГ (DAG)] и
монооксид азота (NO).
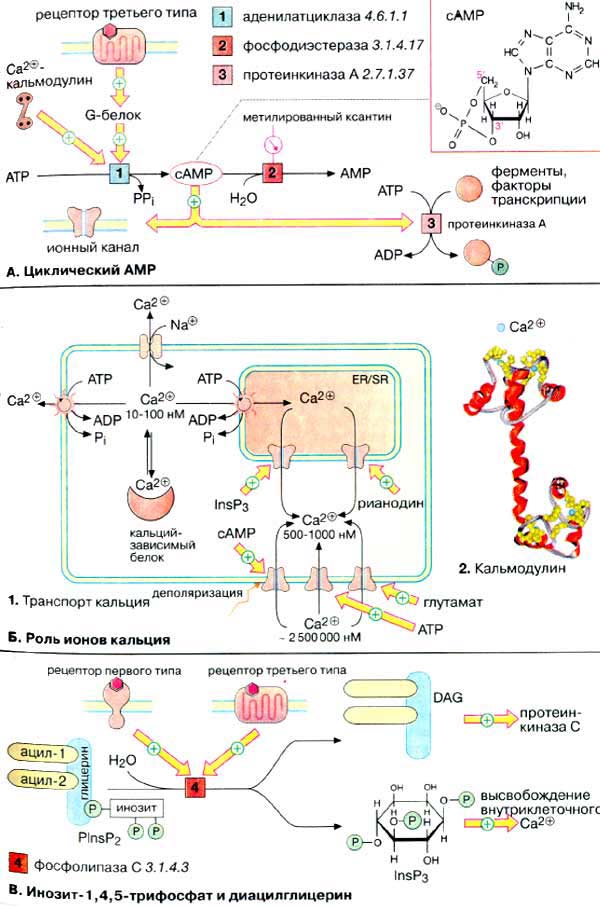
А. Циклический АМФ
Биосинтез. Нуклеотид цАМФ
(3',5'-циклоаденозинмонофосфат, сАМР} синтезируется мембранными
аденилатциклазами [1] — семейством ферментов, катализирующих реакцию
циклизации АТФ (АТР) с образованием цАМФ и неорганического пирофосфата.
Расщепление цАМФ с образованием АМФ (AMP) катализируется фосфодиэстеразами
[2], которые ингибируются при высоких концентрациях метилированных
производных ксантина, например кофеином.
Активность аденилатциклазы
контролируется G-белками, которые в свою очередь сопряжены с рецепторами
третьего типа, управляемыми внешними сигналами (см. с. 372). Большинство
G-белков (Gs-белки) активируют аденилатциклазу, некоторые G-белки ее
ингибируют (Gi-белки). Некоторые аденилатциклазы активируются
комплексом Са2+/кальмодулин.
Механизм действия. цАМФ является аллостерическим эффектором
протеинкиназ А (ПК-Α) [3] и ионных
каналов (см. с. 372). В неактивном состоянии ПК-Α
является тетрамером, две каталитические субъединицы (К-субъединицы) которого
ингибированы регуляторными субъединицами (Р-субъединицы) (аутоингибирование).
При связывании цАМФ Р-субъединицы диссоциируют из комплекса и К-единицы активируются.
Фермент может фосфорилировать определенные остатки серина и треонина в более
чем 100 различных белках, в том числе во многих ферментах (см. с. 158)
и факторах транскрипции. В результате фосфорилирования изменяется функциональная
активность этих белков.
Наряду с цАМФ функции вторичного
мессенджера может выполнять и цГМФ (cGMP) (см. с. 346). Оба соединения
различаются по метаболизму и механизму действия.
Б. Роль ионов кальция
Уровень ионов кальция. Концентрация ионов Са2+
в цитоплазме нестимулированной клетки очень низка (10-100 нМ). Низкий уровень
поддерживается кальциевыми АТФ-азами (кальциевыми насосами) и натрий-кальциевыми
обменниками. Резкое повышение концентрации ионов Са2+ в цитоплазме
(до 500-1000 нМ) происходит в результате открывания кальциевых каналов плазматической
мембраны или внутриклеточных кальциевых депо (гладкого и шероховатого эндоплазматического
ретикулума). Открывание каналов может быть вызвано деполяризацией мембран
или действием сигнальных веществ, нейромедиаторов (глутамат и
АТФ, см. с. 342), вторичных мессенджеров (ИФ3
и цАМФ), а также вещества растительного происхождения рианодина. В
цитоплазме и клеточных органеллах имеется множество белков способных связывать
Са2+, некоторые из них выполняют роль буфера.
При высокой концентрации в цитоплазме
ионы Са2+ оказывает на клетку цитотоксическое действие. Поэтому
уровень кальция в отдельной клетке испытывает кратковременные всплески,
увеличиваясь в 5-10 раз, а стимуляция клетки увеличивает лишь частоту этих
флуктуаций.
Действие кальция опосредовано
специальными Са2+-связывающими белками («кальциевыми
сенсорами»), к которым принадлежат аннексин, кальмодулин и
тропонин (см. с. 326). Кальмодулин — сравнительно небольшой белок
(17 кДа) — присутствует во всех животных клетках. При связывании четырех ионов
Са2+ (на схеме голубые кружочки) кальмодулин переходит в активную
форму, способную взаимодействовать с многочисленными белками. За счет
активации кальмодулина ионы Са2+ оказывают влияние на активность
ферментов, ионных насосов и компонентов цитоскелета.
B. Инозит-1,4,5-трифосфат и
диацилглицерин
Гидролиз
фосфатидилинозит-4,5-дифосфата [ФИФ2 (PlnsP2)]
фосфолипазой С [4] приводит к образованию двух вторичных мессенджеров:
инозит-1,4,5-трифосфата и диацилглицерина. Гидрофильный ИФ3 поступает
в эндоплазматический ретикулум [ЭР (ЕR)] и индуцирует высвобождение ионов
Са2+ из запасающих везикул. Липофильный ДАГ остается в мембране и
активирует протеинкиназу C, которая в присутствии Са2+
фосфорилирует различные белковые субстраты, модулируя их функциональную
активность.