


Метаболизм белков
Трансаминирование и дезаминирование
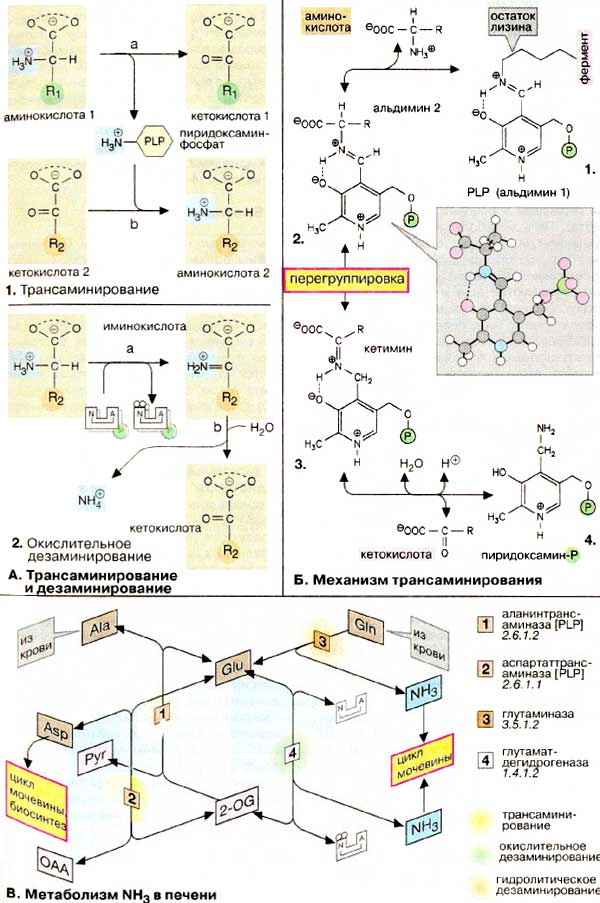 В ходе деградации белков накапливается
аминный азот, который в отличие от углерода не пригоден для получения энергии за
счет окисления. Поэтому те аминогруппы, которые не могут быть повторно
использованы для биосинтеза, превращаются в мочевину (см. с. 184) и выводятся из
организма.
В ходе деградации белков накапливается
аминный азот, который в отличие от углерода не пригоден для получения энергии за
счет окисления. Поэтому те аминогруппы, которые не могут быть повторно
использованы для биосинтеза, превращаются в мочевину (см. с. 184) и выводятся из
организма.
А. Трансаминирование и дезаминирование
Из реакции переноса NH2 наиболее важны реакции трансаминирования
(1). Они катализируются трансаминазами и
участвуют в катаболических и анаболических процессах с участием аминокислот.
При трансаминировании аминогруппа аминокислоты (аминокислота 1) переносится
на 2-кетокислоту (кетокислота 2). Из аминокислоты при этом образуется 2-кетокислота
(а), а из первоначальной кетокислоты — аминокислота
(b). Переносимая NH2-группа временно
присоединяется к связанному с ферментом пиридоксальфосфату (PLP, см.
с. 110), который вследствие этого переходит в пиридоксаминофосфат
(схема Б).
Если NH2-группа освобождается в виде аммиака, то
говорят о дезаминировании (2). Эта реакция
протекает по различным механизмам. Отщепление NH3 от амидной группы
называют гидролитическим дезаминированием (схема В,
фермент [3]). Иногда отщепление NH3
(см. с. 20) сопровождается образованием двойной связи (элиминирующее
дезаминирование, не показано). Особенно важно окислительное дезаминирование
(2). В такой реакции аминогруппа вначале окисляется
до иминогруппы (2а), при этом восстановительные
эквиваленты переносятся на НАД+ или НАДФ+. На второй стадии
происходит гидролитическое отщепление иминогруппы. В качестве конечного
продукта, как и при трансаминировании, образуется 2-кетокислота (схема В).
Б. Механизм трансаминирования
В отсутствие субстратов альдегидная группа пиридоксальфосфата
ковалентно связана с остатком лизина трансаминазы (1).
Этот тип соединения, найденный также в родопсинах (см. с. 346),
относится к альдиминам или шиффовым основаниям, во время реакции аминокислота
1 (схема А, 1 а) вытесняет остаток лизина и образуется
новый альдимин (2). Затем за счет изомеризации
происходит перемещение двойной связи. Полученный кетимин (3)
гидролизуется до 2-кетокислоты и пиридоксаминфосфата (4).
На второй части реакции (схема А, 1б) те же стадии
протекают в противоположном направлении: пиридоксаминфосфат и вторая
2-кетокислота образуют кетимин, который иэомеризуется в альдимин. Наконец, отщепляется
вторая аминокислота и регенерируется кофермент.
В. Метаболизм NH3 в
печени
Образование предшественников NH3 и аспартата, как
и синтез мочевины (см. с. 184), происходит преимущественно
в печени. Накапливающийся в тканях аминный азот переносится кровью в печень
в форме глутамина (Gln) и аланина (Ala, см. с. 330).
В печени Gln дезаминируется глутаминазой [3]
с образованием глутамата (Glu) и NH3. Аминогруппа аланина
переносится аланинтрансаминазой [1] на 2-оксоглутарат
(2-OG). При этом трансаминировании (схема А) также
образуется глутамат. Наконец, из глутамата путем окислительного дезаминирования
(схема А) высвобождается NH3. Эта реакция
катализируется глутаматдегидрогеназой [4],
типичным для печени ферментом. Аспартат (Asp), второй донор аминогруппы в цикле
мочевины, также образуется из глутамата. Аспартаттрансаминаза [2],
ответственная за эту реакцию, подобно аланинтрансаминазе [1],
присутствует в печени.
Трансаминазы присутствуют также в других
тканях, из которых при повреждении клеток они переходят в кровь. Определение
активности фермента в сыворотке (ферментная серодиагностика) является
важным методом для обнаружения и клинического контроля таких нарушений.
Определение активности трансаминаз в крови важно для диагноза заболеваний печени
(например, гепатита) и сердца (инфаркт миокарда).