


Метаболизм белков
Протеолиз
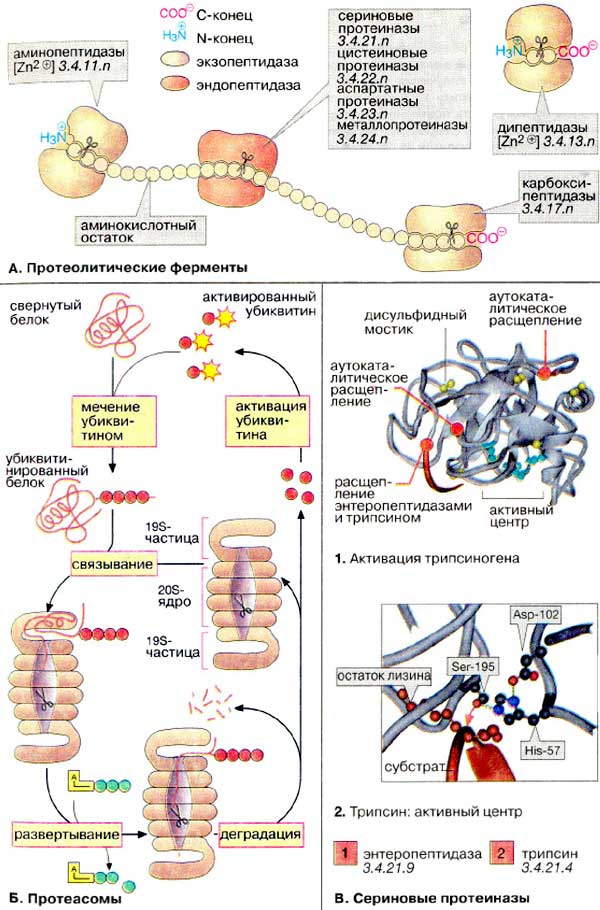 А. Протеолитические
ферменты
А. Протеолитические
ферменты
Для полного расщепления белков до свободных аминокислот необходимо
несколько ферментов с различной специфичностью. Протеиназы и пептидазы
имеются не только в желудочно-кишечном тракте, но и в клетках. По месту атаки
молекулы субстрата протеолитические ферменты делятся на эндопептидазы
и экзопептидазы. Эндопептидазы, или протеиназы, расщепляют
пептидную связь внутри пептидной цепи. Они «узнают» и связывают короткие
пептидные последовательности субстратов и относительно специфично гидролизуют
связи между определенными аминокислотными остатками. Протеиназы классифицируются
по механизму реакции. Сериновые протеиназы (схема В)
содержат в активном центре важный для каталитического действия этих ферментов
остаток серина, в цистеиновых протеиназах таким является остаток цистеина
и т.д. Экзопептидазы гидролизуют пептиды с конца цепи: аминопептидазы
— с N-конца, карбоксипептидазы — с С-конца. Наконец, дипептидазы
расщепляют только дипептиды.
Б. Протеасомы
Поскольку функциональные белки клетки
должны быть защищены от преждевременного протеолиза, часть протеолитических
ферментов клетки заключена в липосомы (см. с. 228). Другая хорошо регулируемая
система деградации белков локализована в цитоплазме. Она состоит из больших
белковых комплексов (молекулярная масса 2ּ106 Да),
протеасом. Протеасомы содержат бочковидное ядро из 28 субъединиц и имеют
коэффициент седиментации (см. с. 202) 20S. Протеолитическая активность (на схеме
показана в виде ножниц) локализована во внутреннем 20S-ядре. С торцов бочки
запираются сложно устроенными 19S-частицами, контролирующими доступ в
ядро.
Белки, которым предстоит разрушение в
протеасоме (например, содержащие ошибки транскрипции или состарившиеся
молекулы), метятся путем ковалентного связывания с небольшим белком
убиквитином. Убиквитин активирован благодаря наличию тиолсложноэфирной
связи. Меченые убиквитином («убиквитинированные») молекулы распознаются
19S-частицами с потреблением АТФ и попадают в ядро, где происходит их
деградация. Убиквитин не разрушается и после активации используется
вновь.
В. Сериновые
протеиназы
Большая группа протеиназ содержит в
активном центре серин. К сериновым протеиназам принадлежат, например, ферменты
пищеварения трипсин, химотрипсин и эластаза (см. с. 262), многие
факторы свертывания крови (см. с. 282), а также фибринолитический фермент
плазмин и его активаторы (см. с. 284).
Как показано на рис. 265, панкреатические
протеиназы секретируются в виде проферментов (зимогенов). Активация таких
ферментов основана на протеолитическом расщеплении. Процесс активации показан
на примере трипсиногена, предшественника трипсина (1).
Она начинается с отщепления N-концевого гексапептида энтеропептидазой («энтерокиназой»),
специфической сериновой протеиназой, которая локализована в мембранах кишечного
эпителия. Продукт расщепления (β-трипсин) ферментативно активен и расщепляет
следующую молекулу трипсиногена в местах, отмеченных на рисунке красным цветом
(аутокаталитическая активация). Проферменты химотрипсина, эластазы, карбоксипептидазы
А и др. также активируются трипсином.
Активный центр трипсина показан на схеме 2.
Остаток серина при участии остатков гистидина и аспартата нуклеофильно атакует
расщепляемую связь (красная стрелка). Отщепляемая часть пептидного субстрата
расположена в С-концевой стороне от остатка лизина, боковая цепь которого во
время катализа фиксируется в специальном «кармане» фермента (на схеме слева).