


Метаболизм. Ферменты
Лактатдегидрогеназа: механизм каталитической реакции
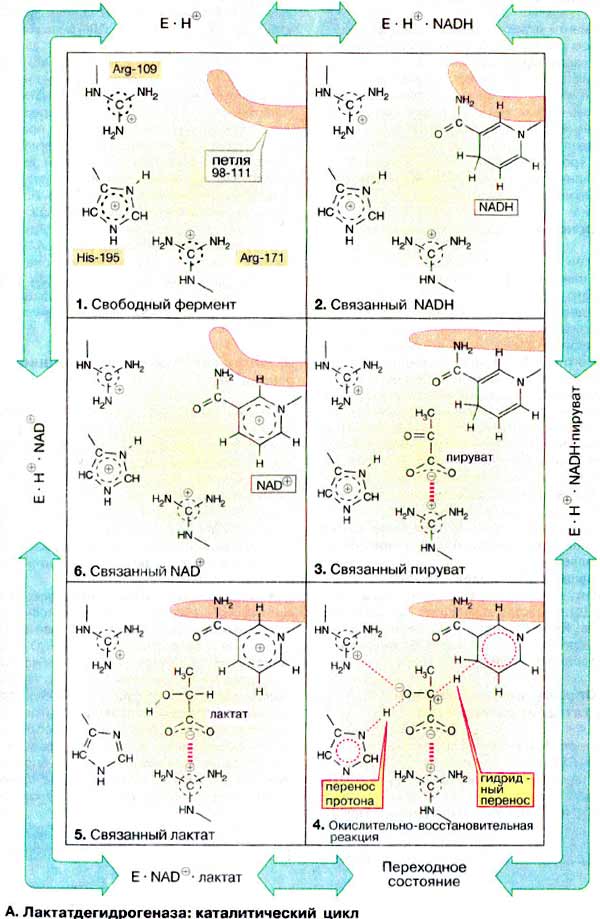 Механизм действия лактатадегидрогеназы (ЛДГ) можно представить
на основе общих закономерностей ферментативного катализа, которые изложены на
с. 96.
Механизм действия лактатадегидрогеназы (ЛДГ) можно представить
на основе общих закономерностей ферментативного катализа, которые изложены на
с. 96.
А. Лактатдегидрогеназа: каталитический
цикл
ЛДГ катализирует передачу восстановительного
эквивалента от лактата на НАД+ (NАD+) или от НАДН (NADH)
на пируват.
L-лактат + НАД+ ↔ пируват + НАДН
+ H+
Равновесие реакции сдвинуто в сторону образования лактата (см.
с. 24). Однако при высоких концентрациях лактата и НАД+
возможно окисление лактата в пируват. ЛДГ катализирует реакцию в обоих направлениях,
но подобно всем ферментам не влияет на положение химического равновесия.
Из-за обратимости реакции каталитический
процесс можно представить в виде движения по кругу. Каталитический цикл
ЛДГ представлен на схеме в виде шести моментальных «снимков». Приведенные на
схеме промежуточные стадии катализа очень кратковременны и поэтому строго не
доказаны. Однако их существование подтверждается множеством экспериментальных
данных
В активном центре ЛДГ принимают участие многие аминокислотные
остатки. Они способствуют присоединению субстратов и кофермента или непосредственно
участвуют в одной из стадий катализа. Здесь показаны лишь три особенно важные
боковые цепи аминокислот: положительно заряженная гуанидиновая группа аргинина-171
связывает карбоксильную группу субстрата с помощью электростатического взаимодействия,
имидазольная группа гистидина-195 принимает участие в кислотно-основном
катализе, боковая цепь аргинина-109 важна для стабилизации переходного
состояния. В противоположность His-195, меняющему свой заряд во время катализа,
оба упомянутых остатка аргинина протонированы постоянно. Кроме этих трех остатков
важную роль играет пептидная петля 98-111, показанная схематически (окрашена
в малиновый цвет) на рис. 103. Ее функция состоит в том,
чтобы после связывания субстрата и кофермента закрыть активный центр и исключить
доступ молекул воды во время переноса электронов.
Рассмотрим теперь отдельные стадии катализируемого ЛДГ восстановления
пирувата: в свободном ферменте (1) His-195 протонирован,
в связи с чем эта форма обозначена как E ∙ H+ . Кофермент НАДН
связывается первым (2), а за ним - пируват (3)
Важно, что в молекуле фермента карбонильная группа пирувата и никотинамидное
кольцо кофермента в активированном состоянии расположены друг относительно друга
оптимально и такая ориентация фиксирована (сближение и ориентирование субстратов).
Затем закрывается петля 98-111 над активным центром. Сильно пониженная полярность
в области активного центра облегчает образование переходного состояния (4;
доступ воды закрыт). В переходном состоянии гидрид-ион H-
(см. с. 104) переносится с кофермента на карбонильный
углерод (перенос группы). При этом временно образующийся энергетически
невыгодный отрицательный заряд на кислороде стабилизируется электростатическим
взаимодействием с Arg-109 (стабилизация переходного состояния). Одновременно
осуществляется перенос протона с Нis-195 на атом кислорода (перенос группы),
приводя к образованию связанных с ферментом лактата и НАД+ (5).
После открытия петли лактат диссоциирует с фермента и временно незаряженная
имидазольная группа Нis-195 снова присоединяет протон из окружающей воды (6).
Наконец, освобождается также окисленный кофермент НАД+ и снова достигается
исходное состояние (1). При окислении лактата в
пируват протекают то же стадии, но в противоположном направлении
Входящий в уравнение реакции протон
присоединяется не одновременно с NADH а после освобождения лактата, т. е. между
стадиями (5) и (6) предшествующего цикла.