|
Кафедра неорганической химии
Учебные материалы по неорганической химии
[содержание] [следующий раздел]
Введение
Учебное пособие по химии халькогенов - второе в
серии, посвященной химии элементов главных
подгрупп периодической системы Д.И.Менделеева.
Оно написано на основе курса лекций по
неорганической химии, читаемого в МГУ на
протяжении последних 10 лет академиком
Ю.Д.Третьяковым и профессором В.П.Зломановым.
В отличие от ранее выпущенных методических
разработок в пособии представлен новый
фактический материал (катенация, многообразие
оксокислот халькогенов (VI) и т.д.), дано
современное объяснение закономерностей
изменения строения и свойств соединений
халькогенов с использованием представлений
квантовой химии, включая метод молекулярных
орбиталей, релятивистский эффект и т.д. Материал
пособия отобран с целью наглядной иллюстрации
взаимосвязи теоретического курса и практических
занятий по неорганической химии.
Авторы благодарны М.Е.Тамм, Г.Н.Куприяновой,
А.В.Шевелькову, И.Н.Одину за полезные замечания и
советы, которые способствовали улучшению
качества пособия.
[предыдущий раздел] [содержание] [следующий
раздел]
§ 1. Общая характеристика
халькогенов (Э).
К элементам VI главной подгруппы (или 16-ой группы
по новой номенклатуре ЮПАК) периодической
системы элементов Д.И.Менделеева относятся
кислород (О), сера (S), селен (Se), теллур (Te) и полоний
(Ро). Групповое название этих элементов - халькогены
(термин "халькоген" происходит от
греческих слов "chalkos"-медь и "genos"-
рожденный ), то есть "рождающие медные руды",
обусловлено тем, что в природе они встречаются
чаще всего в форме соединений меди (сульфидов,
оксидов, селенидов и т.д.).
В основном состоянии атомы халькогенов имеют
электронную конфигурацию ns2np4 с
двумя неспаренными р-электронами. Они
принадлежат к четным элементам. Некоторые
свойства атомов халькогенов представлены в
табл.1.
При переходе от кислорода к полонию размер
атомов и их возможные координационные числа
увеличиваются, а энергия ионизации (Еион) и
электроотрицательность (ЭО) уменьшаются. По
электроотрицательности (ЭО) кислород уступает
лишь атому фтора, а атомы серы и селена также
азоту, хлору, брому; кислород, сера и селен
относятся к типичным неметаллам.
В соединениях серы, селена, теллура с
кислородом и галогенами реализуются степени
окисления +6, +4 и +2. С большинством других
элементов они образуют халькогениды, где
находятся в степени окисления -2.
Таблица 1.Свойства атомов
элементов VI группы.
Элемент
Свойства |
O |
S |
Se |
Te |
Po |
| Атомный номер |
8 |
16 |
34 |
52 |
84 |
| Число стабильных изотопов |
3 |
4 |
6 |
8 |
0 |
Электронная
конфигурация |
[He]2s22p4 |
[Ne]3s23p4 |
[Ar]3d104s24p4 |
[Kr]4d105s25p4 |
[Xe]4f145d106s26p4 |
| Ковалентный радиус, Е |
0.74 |
1.04 |
1.40 |
1.60 |
1.64 |
| Первая энергия ионизации, Еион,
кДж/моль |
1313.9 |
999.6 |
940.9 |
869.3 |
812.0 |
| Элекроотрицательность (Полинг) |
3.5 |
2.5 |
2.4 |
2.1 |
2.0 |
| Сродство атома к электрону,
кДж/моль |
140.98 |
200.41 |
195.0 |
190.2 |
183 |
Устойчивость соединений с высшей степенью
окисления уменьшается от теллура к полонию, для
которого известны соединения со степенью
окисления 4+ и 2+ (например, PoCl4, PoCl2, PoO2).
Это может быть связано с увеличением прочности
связи 6s2 электронов с ядром из-за релятивистского
эффекта. Суть его заключается в увеличении
скорости движения и соответственно массы
электронов у элементов с большим зарядом ядра
(Z>60). "Утяжеление" электронов приводит к
уменьшению радиуса и повышению энергии связи
6s-электронов с ядром. Более наглядно этот эффект
проявляется в соединениях висмута, элемента V
группы, и подробнее рассмотрен в соответствующем
пособии.
Свойства кислорода, как и других элементов 2-го
периода, отличаются от свойств своих более
тяжелых аналогов. Из-за высокой электронной
плотности и сильного межэлектронного
отталкивания сродство к электрону и прочность
связи Э- Э у кислорода меньше, чем у серы. Связи
металл-кислород (М- О) являются более ионными, чем
связи М- S, М- Se и т.д. В силу меньшего радиуса атом
кислорода в отличие от серы способен
образовывать прочные  -связи (р -связи (р - р - р ) с другими
атомами - например, кислородом в молекуле озона,
углеродом, азотом, фосфором. При переходе от
кислорода к сере прочность одинарной ) с другими
атомами - например, кислородом в молекуле озона,
углеродом, азотом, фосфором. При переходе от
кислорода к сере прочность одинарной  -связи растет из-за уменьшения
межэлектронного отталкивания, а прочность -связи растет из-за уменьшения
межэлектронного отталкивания, а прочность  -связи уменьшается, что связано с
ростом радиуса и уменьшением взаимодействия
(перекрывания) р-атомных орбиталей. Таким
образом, если для кислорода характерно
образование кратных ( -связи уменьшается, что связано с
ростом радиуса и уменьшением взаимодействия
(перекрывания) р-атомных орбиталей. Таким
образом, если для кислорода характерно
образование кратных ( + + ) связей, то для серы и ее аналогов -
образование одинарных цепных связей - Э- Э- Э (см. §
2.1). ) связей, то для серы и ее аналогов -
образование одинарных цепных связей - Э- Э- Э (см. §
2.1).
В свойствах серы, селена и теллура
прослеживается больше аналогий, чем с кислородом
и полонием. Так, в соединениях с отрицательными
степенями окисления от серы к теллуру
увеличиваются восстановительные, а в
соединениях с положительными степенями
окисления - окислительные свойства.
Полоний - радиоактивный элемент. Наиболее
стабильный изотоп 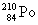 получают в результате бомбардировки ядер
получают в результате бомбардировки ядер 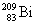 нейтронами и
последующего нейтронами и
последующего  -распада -распада 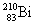 : :
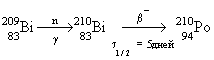 ( ( 1/2 = 138.4 дня).
1/2 = 138.4 дня).
 -распад полония
сопровождается выделением большого количества
энергии. Поэтому полоний и его соединения
разлагают растворители и сосуды, в которых
хранятся, а изучение соединений Ро представляет
значительные трудности. -распад полония
сопровождается выделением большого количества
энергии. Поэтому полоний и его соединения
разлагают растворители и сосуды, в которых
хранятся, а изучение соединений Ро представляет
значительные трудности.
[предыдущий раздел] [содержание] [следующий
раздел]
§ 2. Физические свойства простых
веществ.
Таблица 2. Физические свойства простых веществ.
Элемент |
Плотность |
Температуры, оС |
Теплота атомизации,
кДж/моль |
Электрическое
Сопротивление(25оС), Ом. см |
плавления |
кипения |
О |
1.429. 10-3
1.14(жидк.) |
-218.79 |
-182.97 |
|
|
| S |
 |
2.05 |
95.5 |
446 |
|
|
 |
1.96 |
119.3 |
|
294.3 |
|
| Sе |
гекс. |
4.819 |
220 |
685 |
206.7 |
1010 |
 |
4.389 |
|
|
|
1.3. 105 (жидк., 400оС) |
| Те гекс. |
гекс. |
6.24 |
449.8 |
990 |
192 |
1 |
| Ро |
 |
9.142 |
254 |
962 |
- |
4.2. 10-5
- |
 |
9.352 |
- |
- |
- |
- |
С ростом ковалентного радиуса в ряду O- S- Se- Te- Po
межатомное взаимодействие и соответствующие
температуры фазовых переходов, а также энергии
атомизации, то есть энергии перехода твердых
простых веществ в состояние одноатомного газа,
увеличиваются. Изменение свойств халькогенов от
типичных неметаллов к металлам связан с
уменьшением энергии ионизации (табл.1) и
особенностями строения. Кислород и сера -
типичные диэлектрики, то есть вещества, не
проводящие электрический ток. Селен и теллур - полупроводники
[вещества, электрофизические свойства которых
являются промежуточным между свойствами
металлов и неметаллов (диэлектриков).
Элктропроводность металлов уменьшается, а
полупроводников увеличивается с повышением
температуры, что обусловлено особенностями их
электронного строения)] , а полоний - металл.
[предыдущий раздел] [содержание] [следующий
раздел]
§ 2.1. Катенация халькогенов.
Аллотропия и полиморфизм.
Одно из характерных свойств атомов халькогенов
- их способность связываться друг с другом в
кольца или цепи. Это явление называют катенацией.
Причина его связана с различной прочностью
одинарных и двойных связей. Рассмотрим это
явление на примере серы (табл.3).
Таблица 3. Энергии одинарных и
двойных связей (кДж/моль).
Элемент |
Связь Э=Э |
Энергия |
Связь Э- Э- Э |
Энергия |
| Кислород |
О=О |
493.6 |
О-О-О |
146х2=292 |
| Сера |
S=S |
421.3 |
S-S-S |
265х2=530 |
Из приведенных значений следует, что
образование двух одинарных  -связей
для серы вместо одной двойной ( -связей
для серы вместо одной двойной ( + + ) связано с выигрышем в энергии (530 -
421 = 109 Дж/моль). Для кислорода, напротив, одна
двойная связь энергетически предпочтительнее
(494-292=202 кДж/моль), чем две одинарные. Уменьшение
прочности двойной связи при переходе от О к S
связано с увеличением размеров р-орбиталей и
уменьшением их перекрывания. Таким образом для
кислорода катенация ограничивается небольшим
числом нестойких соединений: O3 озон, O4F2. ) связано с выигрышем в энергии (530 -
421 = 109 Дж/моль). Для кислорода, напротив, одна
двойная связь энергетически предпочтительнее
(494-292=202 кДж/моль), чем две одинарные. Уменьшение
прочности двойной связи при переходе от О к S
связано с увеличением размеров р-орбиталей и
уменьшением их перекрывания. Таким образом для
кислорода катенация ограничивается небольшим
числом нестойких соединений: O3 озон, O4F2.
Более ярко катенация наблюдается у серы, селена
и теллура. Для них известны многочисленные
линейные и циклические молекулярные формы,
образованные цепочками - Э- Э- . Методами
хроматографии идентифицированы циклы Sn,
где 6 n n  23.
Бесконечные цепи Эn обнаружены для серы,
селена, теллура. 23.
Бесконечные цепи Эn обнаружены для серы,
селена, теллура.
Катенация не ограничивается простыми
веществами. Известны соединения, содержащие
гомоатомные циклы и цепи, стабилизированные
концевыми - H, - Cl или группами - 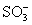 , например: , например:
С катенацией сязаны аллотропия и полиморфизм
простых веществ. Аллотропия - это способность
одного и того же элемента существовать в разных
молекулярных формах. Явление аллотропии относят
к молекулам, содержащим разное количество атомов
одного и того же элемента, например, О2 и О3,
S2 и S8, Р2 и Р4 и т.д. Понятие
полиморфизма относится только к твердым
веществам. Полиморфизм - способность
твердого вещества с одним и тем же составом иметь
разное пространственное строение. Примерами
полиморфных модификаций являются сера
моноклинная и сера ромбическая, состоящие из
одинаковых циклов S8, но размещенных в
пространстве по-разному (см. § 2.3). Рассмотрим
сначала свойства кислорода и его аллотропной
формы - озона, а затем полиморфизм серы, селена и
теллура.
[предыдущий раздел] [содержание] [следующий
раздел]
|

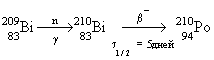 (
(