С. Т. Жуков Химия 8-9 класс
Глава 12.Химические реакции в растворах (2)
12.4. Сила кислот и оснований
Направление смещения кислотно-основного
равновесия определятся следующим правилом:
Кислотно-основные равновесия смещены в
сторону более слабой кислоты и более слабого
основания.
Кислота тем сильнее, чем легче она
отдает протон, а основание тем сильнее, чем легче
оно принимает протон и прочнее его удерживает.
Молекула (или ион) слабой кислоты не склонна
отдавать протон, а молекула (или ион) слабого
основания не склонна его принимать, этим и
объясняется смещение равновесия в их сторону.
Силу кислот, а также силу оснований можно
сравнивать только в одном и том же растворителе
Так как кислоты могут реагировать с разными
основаниями, то соответствующие равновесия
будут смещены в ту или иную сторону в разной
степени. Поэтому для сравнения силы разных
кислот определяют, насколько легко эти кислоты
отдают протоны молекулам растворителя.
Аналогично определяется и сила оснований.
Сила кислоты –
характеристика кислоты, показывающая, насколько
легко кислота отдает протоны молекулам данного
растворителя.
Сила основания – характеристика основания,
показывающая, насколько прочно основание
связывает протоны, оторванные от молекул данного
растворителя. |
Вы уже знаете, что молекула воды
(растворителя) может и принимать, и отдавать
протон, то есть проявляет и свойства кислоты, и
свойства основания. Поэтому и кислоты, и
основания можно сравнивать между собой по силе в
водных растворах. В одном и том же растворителе
сила кислоты в значительной степени зависит от
энергии рвущейся связи А—Н, а сила основания –
от энергии образующейся связи В—Н.
Для количественной характеристики силы кислоты
в водных растворах можно использовать константу
кислотно-основного равновесия обратимой реакции
данной кислоты с водой:
HА + Н2О 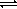 А
А +
H3O
+
H3O .
.

Для характеристики силы кислоты в
разбавленных растворах, в которых концентрация
воды практически постоянна, пользуются константой
кислотности:
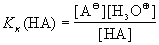 ,
,
где Kк(HA) = Kc·[H2O].
Совершенно аналогично для
количественной характеристики силы основания
можно использовать константу кислотно-основного
равновесия обратимой реакции данного основания
с водой:
А + Н2О
+ Н2О
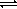 НА + ОН
НА + ОН ,
,
а в разбавленных растворах – константу
основности
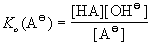 , где Kо(HA) = Kc·[H2O].
, где Kо(HA) = Kc·[H2O].
Практически для оценки силы основания
используют константу кислотности кислоты,
получающейся из данного основания (так
называемой " сопряженной " кислоты), так
как эти константы связаны простым соотношением
Ко(А )
= К(Н2О)/Кк(НА).
)
= К(Н2О)/Кк(НА).
Иными словами, основание тем
сильнее, чем слабее сопряженная кислота. И
наоборот, кислота тем сильнее, чем слабее
сопряженное основание.
Константы кислотности и основности,
как правило, определяются экспериментально.
Значения констант кислотности различных кислот
приведены в приложении 13, а значения констант
основности оснований – в приложении 14.
Для оценки того, какая часть молекул кислоты или
основания в состоянии равновесия подверглась
реакции с водой, используется величина,
аналогичная (и однородная) мольной доле и
называемая степенью протолиза ( ). Для кислоты НА
). Для кислоты НА
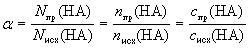 .
.
Здесь величина с индексом " пр" (в
числителе) характеризует прореагировавшую часть
молекул кислоты НА, а величина с индексом "
исх" (в знаменателе) – исходную порцию кислоты.
В соответствии с уравнением реакции
nпр(HA) = n(H3O ) = n(A
) = n(A )
)  cпр(HA) = c(H3O
cпр(HA) = c(H3O  ) = c(A
) = c(A  );
);
[H3O ] = [A
] = [A ] = a · сисх(НА);
] = a · сисх(НА);
[HA] = (1 – a ) · сисх(НА).
Подставив эти выражения в уравнение
константы кислотности, получим
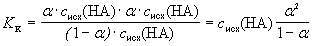 .
.
Таким образом, зная константу
кислотности и общую концентрацию кислоты, можно
определить степень протолиза этой кислоты в
данном растворе. Аналогично через степень
протолиза можно выразить и константу основности
основания, поэтому в общем виде
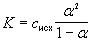
Это уравнение представляет собой
математическое выражение закона разбавления
Оствальда. Если растворы разбавленные, то есть
исходная концентрация не превышает 0,01 моль/л, то
можно использовать приближенное соотношение
K =  2·cисх.
2·cисх.
Для грубой оценки степени протолиза
это уравнение можно использовать и при
концентрациях до 0,1 моль/л.
Кислотно-основные реакции – процессы обратимые,
но не всегда. Рассмотрим поведение в воде молекул
хлороводорода и фтороводорода:
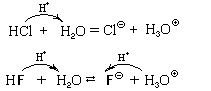
Молекула хлороводорода отдает протон
молекуле воды и превращается в хлорид-ион.
Следовательно, в воде хлороводород проявляет свойства
кислоты, а сама вода – свойства основания.
Тоже происходит и с молекулой фтороводорода, и,
следовательно, фтороводород тоже проявляет
свойства кислоты. Поэтому водный раствор
хлороводорода называют хлороводородной (или
соляной) кислотой , а водный раствор
фтороводорода – фтороводородной (или
плавиковой) кислотой. Но между этими кислотами
есть существенное различие: соляная кислота
реагирует с избытком воды необратимо (полностью),
а плавиковая – обратимо и незначительно.
Следовательно, молекула хлороводорода легко
отдает протон молекуле воды, а молекула
фтороводорода делает это с трудом. Поэтому
соляная кислота относится к сильным кислотам,
а плавиковая – к слабым.
Сильная кислота –
кислота, реагирующая с избытком воды необратимо.
Слабая кислота – кислота, реагирующая с
избытком воды обратимо и, как правило,
незначительно. |
Сильные кислоты: HCl, HBr, HI, HClO4, HClO3,
H2SO4, H2SeO4, HNO3 и
некоторые другие.
Теперь обратим внимание на правые части
уравнений реакций с водой хлороводорода и
фтороводорода. Фторид-ион может принимать протон
(отрывая его у иона оксония) и превращаться в
молекулу фтороводорода, а хлорид-ион не может.
Следовательно, фторид-ион проявляет свойства
основания, а хлорид-ион таких свойств не
проявляет (но только в разбавленных растворах).
Как и кислоты, существуют сильные и слабые
основания.
Сильное основание –
основание, реагирующее с избытком воды
необратимо.
Слабое основание – основание, реагирующее с
избытком воды обратимо и, как правило,
незначительно. |

К сильным веществам-основаниям
относятся все хорошо растворимые ионные
гидроксиды (их называют еще " щелочами " ),
так как при их растворении в воде гидроксид-ионы
полностью переходят в раствор.
К слабым основаниям относится NH3
(КО = 1,74· 10–5) и некоторые другие
вещества. К ним же относятся и практически
нерастворимые гидроксиды элементов, образующих
металлы, (" гидроксиды металлов" ) потому, что
при взаимодействии этих веществ с водой в
раствор переходит лишь ничтожное количество
гидроксид-ионов.
Слабые основания-частицы (их еще называют " анионные
основания" ): F ,
NO2
,
NO2 , SO32
, SO32 , S2
, S2 , CO32
, CO32 ,
PO43
,
PO43 и другие
анионы, образующиеся из слабых кислот.
и другие
анионы, образующиеся из слабых кислот.
Не обладают основными свойствами анионы Cl , Br
, Br , I
, I , HSO4
, HSO4 , NO3
, NO3 и другие анионы, образующиеся из
сильных кислот
и другие анионы, образующиеся из
сильных кислот
Не обладают кислотными свойствами катионы Li , Na
, Na , K
, K , Ca2
, Ca2 , Ba2
, Ba2 и другие катионы, входящие в состав
сильных оснований.
и другие катионы, входящие в состав
сильных оснований.

Кроме частиц-кислот и
частиц-оснований, существуют еще частицы,
проявляющие и кислотные, и основные свойства.
Такие свойства молекулы воды вам уже известны.
Кроме воды, это гидросульфит-ион,
гидросульфид-ион и другие аналогичные ионы.
Например, HSO3 проявляет как свойства кислоты
проявляет как свойства кислоты
HSO3 + H2O
+ H2O  SO3
SO3 + H3O
+ H3O , так и свойства основания
, так и свойства основания
HSO3 + H2O
+ H2O  H2SO3
+ OH
H2SO3
+ OH .
.
Подобные частицы называются амфолитами.
Амфолит – частица,
способная как отдавать протон молекуле
растворителя, так и принимать протон от молекулы
растворителя. |
Большинство частиц-амфолитов
представляют собой молекулы слабых кислот,
потерявшие часть протонов (HS  , HSO3
, HSO3  , HCO3
, HCO3  , H2PO4
, H2PO4
 , HPO42
, HPO42 и некоторые другие).
Анион HSO4
и некоторые другие).
Анион HSO4  не
проявляет основных свойств и является довольно
сильной кислотой (КК = 1,12.10–2),
а потому к амфолитам не относится. Соли, в состав
которых входят такие анионы, называются кислыми
солями.
не
проявляет основных свойств и является довольно
сильной кислотой (КК = 1,12.10–2),
а потому к амфолитам не относится. Соли, в состав
которых входят такие анионы, называются кислыми
солями.
Кислые соли – соли, в
состав которых входят анионы, способные отдавать
протон. |
Примеры кислых солей и их названий:
KHS – гидросульфид
калия, |
NaHSO4 –
гидросульфат натрия, |
LiHSO3 –
гидросульфит лития, |
Ca(HCO3)2 –
гидрокарбонат кальция, |
KH2PO4 –
дигидрофосфат калия, |
Na2HPO4 –
гидрофосфат натрия. |
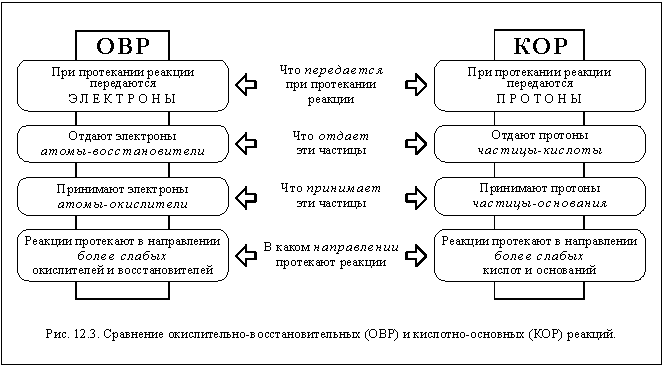
Как вы уже, наверное, заметили, у
кислотно-основных и
окислительно-восстановительных реакций есть
много общего. Проследить общие черты и найти
отличия этих типов реакций вам поможет схема,
изображенная на рисунке 12.3.
 СИЛА
КИСЛОТЫ, СИЛА ОСНОВАНИЯ, КОНСТАНТА КИСЛОТНОСТИ,
КОНСТАНТА ОСНОВНОСТИ, СОПРЯЖЕННАЯ КИСЛОТА,
СОПРЯЖЕННОЕ ОСНОВАНИЕ, СТЕПЕНЬ ПРОТОЛИЗА, ЗАКОН
РАЗБАВЛЕНИЯ ОСТВАЛЬДА, СИЛЬНАЯ КИСЛОТА, СЛАБАЯ
КИСЛОТА, СИЛЬНОЕ ОСНОВАНИЕ, СЛАБОЕ ОСНОВАНИЕ,
ЩЕЛОЧЬ, АНИОННОЕ ОСНОВАНИЕ, АМФОЛИТЫ, КИСЛЫЕ СОЛИ
СИЛА
КИСЛОТЫ, СИЛА ОСНОВАНИЯ, КОНСТАНТА КИСЛОТНОСТИ,
КОНСТАНТА ОСНОВНОСТИ, СОПРЯЖЕННАЯ КИСЛОТА,
СОПРЯЖЕННОЕ ОСНОВАНИЕ, СТЕПЕНЬ ПРОТОЛИЗА, ЗАКОН
РАЗБАВЛЕНИЯ ОСТВАЛЬДА, СИЛЬНАЯ КИСЛОТА, СЛАБАЯ
КИСЛОТА, СИЛЬНОЕ ОСНОВАНИЕ, СЛАБОЕ ОСНОВАНИЕ,
ЩЕЛОЧЬ, АНИОННОЕ ОСНОВАНИЕ, АМФОЛИТЫ, КИСЛЫЕ СОЛИ
 1.Какая из кислот в большей степени склонна
отдавать протон в водном растворе а) азотная или
азотистая, б) серная или сернистая, в) серная или
соляная, г) сероводородная или сернистая?
Составьте уравнения реакций. В случае обратимых
реакций запишите выражение для констант
кислотности.
1.Какая из кислот в большей степени склонна
отдавать протон в водном растворе а) азотная или
азотистая, б) серная или сернистая, в) серная или
соляная, г) сероводородная или сернистая?
Составьте уравнения реакций. В случае обратимых
реакций запишите выражение для констант
кислотности.
2.Сравните энергию атомизации молекул HF и HCl.
Согласуются ли эти данные с силой плавиковой и
соляной кислот?
3.Какая частица является более сильной кислотой:
а) молекула угольной кислоты или
гидрокарбонат-ион, б) молекула фосфорной кислоты,
дигидрофосфат-ион или гидрофосфат-ион, в)
молекула сероводорода или гидросульфид-ион?
4.Почему в приложении 13 вы не найдете константы
кислотности серной, соляной, азотной и некоторых
других кислот?
5.Докажите справедливость соотношения,
связывающего константу основности и константу
кислотности сопряженных кислоты и основания.
6.Запишите уравнения реакций с водой а)
бромоводорода и азотистой кислоты, б) серной и
сернистой кислот, в) азотной кислоты и
сероводорода. В чем отличия этих процессов?
7.Для следующих амфолитов: HS  , HSO3
, HSO3  ,
HCO3
,
HCO3  , H2PO4
, H2PO4
 , HPO42
, HPO42 , H2O – составьте
уравнения реакций этих частиц с водой, запишите
выражения для констант кислотности и основности,
выпишите значения этих констант из приложений 13
и 14. Определите, какие свойства, кислотные или
основные преобладают у этих частиц?
, H2O – составьте
уравнения реакций этих частиц с водой, запишите
выражения для констант кислотности и основности,
выпишите значения этих констант из приложений 13
и 14. Определите, какие свойства, кислотные или
основные преобладают у этих частиц?
8.Какие процессы могут происходить при
растворении в воде фосфорной кислоты?
 Сравнение
реакционной способности сильных и слабых кислот.
Сравнение
реакционной способности сильных и слабых кислот.
12.5. Кислотно-основные реакции ионов
оксония
И кислоты, и основания различаются по силе, по
растворимости, по устойчивости и по некоторым
другим характеристикам. Важнейшей из этих
характеристик является сила. Наиболее
характерно свойства кислот проявляются у
сильных кислот. В растворах сильных кислот
частицами-кислотами являются ионы оксония.
Поэтому в этом параграфе мы рассмотрим реакции в
растворах, протекающие при взаимодействии ионов
оксония с различными веществами, содержащими
частицы-основания. Начнем с самых сильных
оснований.
а) Реакции ионов оксония с оксид-ионами
Среди очень сильных оснований
важнейшим является оксид-ион, входящий в состав
основных оксидов, которые, как вы помните,
представляют собой ионные вещества. Этот ион -
одно из сильнейших оснований. Поэтому основные
оксиды (например, состава MO), даже не реагирующие
с водой, легко реагируют с кислотами. Механизм
реакции:
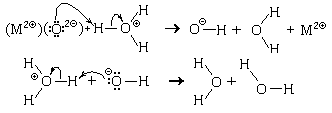
В этих реакциях оксид-ион не успевает
перейти в раствор, а сразу реагирует с ионом
оксония. Следовательно, реакция протекает на
поверхности оксида. Такие реакции идут до конца,
так как из сильной кислоты и сильного основания
образуется очень слабый амфолит (вода).
Пример. Реакция азотной кислоты с
оксидом магния:
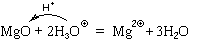
MgO + 2HNO3p = Mg(NO3)2p + H2O.
Так реагируют с сильными кислотами все
основные и амфотерные оксиды, но если образуется
нерастворимая соль, то реакция в некоторых
случаях очень замедляется, так как слой
нерастворимой соли препятствует проникновению
кислоты к поверхности оксида (пример - реакция
оксида бария с серной кислотой).
б) Реакции ионов оксония с
гидроксид-ионами
Из всех частиц-оснований, существующих
в водных растворах, гидроксид-ион является самым
сильным основанием. Его константа основности (55,5)
во много раз превышает константы основности
остальных частиц-оснований. Гидроксид-ионы
входят в состав щелочей и при их растворении
переходят в раствор. Механизм реакции ионов
оксония с гидроксид-ионами:
.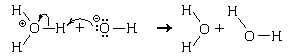
Пример 1. Реакция соляной кислоты с
раствором гидроксида натрия:
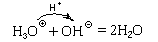
HClp + NaOHp = NaClp + H2O.
Как и реакции с основными оксидами,
такие реакции идут до конца (необратимы) потому,
что в результате передачи протона ионом оксония
(сильной кислотой, KK = 55,5) гидроксид-иону
(сильному основанию, KО = 55,5)
образовались молекулы воды (очень слабого
амфолита, KK = KO = 1,8·10-16).
Вспомним, что реакции кислот с основаниями (в том
числе и со щелочами) называются реакциями
нейтрализации.
Вы уже знаете, что в чистой воде присутствуют
ионы оксония и гидроксид-ионы (за счет
автопротолиза воды), но их концентрации равны и
крайне незначительны: с(Н3О  ) = с(ОН
) = с(ОН  ) = 10-7 моль/л. Поэтому их
присутствие в воде практически незаметно.
) = 10-7 моль/л. Поэтому их
присутствие в воде практически незаметно.
То же наблюдается и в растворах веществ, не
являющихся ни кислотами, ни основаниями. Такие
растворы называют нейтральными.
Нейтральный раствор -
раствор, в котором концентрации ионов оксония и
гидроксид-ионов равны (как в чистой воде). |
Но если в воду добавить
вещество-кислоту или вещество-основание, то в
растворе появится избыток одного из этих ионов.
Раствор станет кислым или щелочным.
Кислый раствор - раствор, в
котором присутствует избыток ионов оксония.
Щелочной раствор - раствор, в котором
присутствует избыток гидроксид-ионов.
Реакции нейтрализации - реакции между
кислотами и основаниями, в результате которых в
растворе практически не остается избытка ионов
оксония и гидроксид-ионов. |
Гидроксид-ионы входят в состав не
только щелочей, но и практически нерастворимых
оснований, а также амфотерных гидроксидов
(амфотерные гидроксиды в этом отношении можно
рассматривать как ионные соединения). Со всеми
этими веществами ионы оксония также реагируют,
причем, как и в случае основных оксидов, реакция
протекает на поверхности твердого вещества.
Механизм реакции для гидроксида состава M(OH)2:
.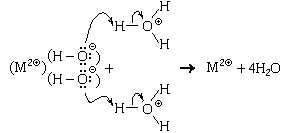
Пример 2. Реакция раствора серной
кислоты с гидроксидом меди. Так как
гидросульфат-ион довольно сильная кислота (KK
 0,01), обратимостью его протолиза можно
пренебречь и записать уравнения этой реакции
следующим образом:
0,01), обратимостью его протолиза можно
пренебречь и записать уравнения этой реакции
следующим образом:
Cu(OH)2 + 2H3O = Cu2
= Cu2 + 4H2O
+ 4H2O
Cu(OH)2 + H2SO4р = CuSO4 + 2H2O.
в) Реакции ионов оксония со слабыми
основаниями
Как и в растворах щелочей, в растворах
слабых оснований также присутствуют
гидроксид-ионы, но их концентрация во много раз
меньше, чем концентрация самих частиц-оснований
(это отношение равно степени протолиза
основания). Поэтому скорость реакции
нейтрализации гидроксид-ионов во много раз
меньше, чем скорость реакции нейтрализации самих
частиц-оснований. Следовательно, преобладающей
будет реакция между ионами оксония и
частицами-основаниями.
Пример 1. Реакция нейтрализации
соляной кислоты раствором аммиака:
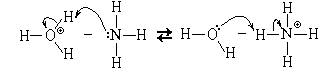 .
.
В результате реакции получаются ионы
аммония (слабая кислота, KK = 6·10-10)
и молекулы воды, но, так как один из исходных
реагентов (аммиак) основание слабое (KO =
2·10-5), то реакция обратима
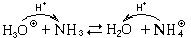
Но равновесие в ней очень сильно
сдвинуто вправо (в сторону продуктов реакции),
настолько сильно, что обратимостью часто
пренебрегают, записывая молекулярное уравнение
этой реакции со знаком равенства:
HClp + NH3p = NH4Clp + H2O.
Пример 2. Реакция бромоводородной
кислоты с раствором гидрокарбоната натрия.
Будучи амфолитом, гидрокарбонат-ион в
присутствии ионов оксония ведет себя как слабое
основание:
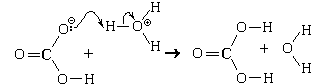
Образующаяся угольная кислота может
содержаться в водных растворах лишь в очень
небольших концентрациях. При увеличении
концентрации она разлагается. Механизм
разложения можно представить себе следующим
образом:
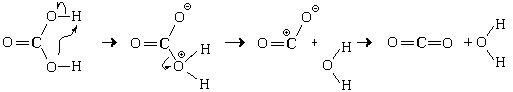
Суммарные химические уравнения:
H3O + HCO3
+ HCO3 = CO2 + 2H2O
= CO2 + 2H2O
HBrр + NaHCO3р = NaBrр + CO2 + H2O.
Пример 3. Реакции, протекающие при
сливании растворов хлорной кислоты и карбоната
калия. Карбонат-ион тоже слабое основание, хотя и
более сильное, чем гидрокарбонат-ион. Реакции
между этими ионами и ионом оксония полностью
аналогичны. В зависимости от условий проведения,
реакция может остановиться на стадии
образования гидрокарбонат-иона, а может привести
и к образованию углекислого газа:
а) H3O + CO3
+ CO3 = HCO3
= HCO3
 + H2O
+ H2O
HClO4р + K2CO3р = KClO4р + KHCO3р;
б) 2H3O + CO3
+ CO3 = CO2 + 3H2O
= CO2 + 3H2O
2HClO4р + K2CO3р = 2KClO4р + CO2 +
H2O.
Аналогичные реакции протекают даже в
том случае, когда соли, содержащие
частицы-основания, нерастворимы в воде. Как и в
случае основных оксидов или нерастворимых
оснований, в этом случае реакция тоже протекает
на поверхности нерастворимой соли.
Пример 4. Реакция между соляной
кислотой и карбонатом кальция:
CaCO3 + 2H3O =
Ca2
=
Ca2 + CO2 + 3H2O
+ CO2 + 3H2O
CaCO3р + 2HClр = CaCl2р + CO2 +
H2O.
+
H2O.
Препятствием к проведению таких
реакций может послужить образование
нерастворимой соли, слой которой будет
затруднять проникновение ионов оксония к
поверхности реагента (например, в случае
взаимодействия карбоната кальция с серной
кислотой).
 НЕЙТРАЛЬНЫЙ
РАСТВОР, КИСЛЫЙ РАСТВОР, ЩЕЛОЧНОЙ РАСТВОР,
РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ.
НЕЙТРАЛЬНЫЙ
РАСТВОР, КИСЛЫЙ РАСТВОР, ЩЕЛОЧНОЙ РАСТВОР,
РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ.
 1.Составьте схемы механизмов реакций ионов
оксония со следующими веществами и частицами: FeO,
Ag2O, Fe(OH)3, HSO3
1.Составьте схемы механизмов реакций ионов
оксония со следующими веществами и частицами: FeO,
Ag2O, Fe(OH)3, HSO3 , PO43
, PO43 и Cu2(OH)2CO3. По схемам составьте
ионные уравнения реакций.
и Cu2(OH)2CO3. По схемам составьте
ионные уравнения реакций.
2.С какими из следующих оксидов будут реагировать
ионы оксония: CaO, CO, ZnO, SO2, B2O3, La2O3?
Составьте ионные уравнения этих реакций.
3.С какими из следующих гидроксидов будут
реагировать ионы оксония: Mg(OH)2, B(OH)3,
Te(OH)6, Al(OH)3? Составьте ионные уравнения
этих реакций.
4.Составьте ионные и молекулярные уравнения
реакций бромоводородной кислоты с растворами
следующих веществ: Na2CO3, K2SO3,
Na2SiO3, KHCO3.
5.Составьте ионные и молекулярные уравнения
реакций раствора азотной кислоты со следующими
веществами: Cr(OH)3, MgCO3, PbO.
 Реакции растворов сильных кислот с основаниями,
основными оксидами и солями.
Реакции растворов сильных кислот с основаниями,
основными оксидами и солями.
12.6. Кислотно-основные реакции слабых
кислот
В отличии от растворов сильных кислот
в растворах слабых кислот в качестве
частиц-кислот присутствуют не только ионы
оксония, но и молекулы самой кислоты, причем
молекул кислоты во много раз больше, чем ионов
оксония. Поэтому в этих растворах преобладающей
реакцией будет реакция самих частиц-кислот с
частицами-основаниями, а не реакции ионов
оксония. Скорость реакций с участием слабых
кислот всегда меньше скорости аналогичных
реакций с участием сильных кислот. Часть этих
реакций обратима, и тем больше, чем слабее
участвующая в реакции кислота.
а) Реакции слабых кислот с оксид-ионами
Это единственная группа реакций
слабых кислот, которые протекают необратимо.
Скорость реакции зависит от силы кислоты.
Некоторые слабые кислоты (сероводородная,
угольная и др.) в реакции с малоактивными
основными и амфотерными оксидами (CuO, FeO, Fe2O3,
Al3O3, ZnO, Cr2O3 и др.) не
вступают.
Пример. Реакция, протекающая между
оксидом марганца(II) и раствором уксусной кислоты.
Механизм этой реакции:
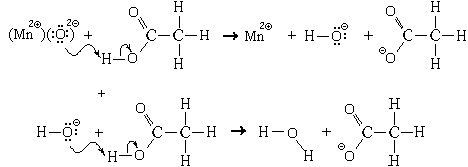
Уравнения реакции:
MnO + 2CH3COOH = Mn2 +
2CH3COO
+
2CH3COO + H2O
+ H2O
MnO + 2CH3COOHр = Mn(CH3COO)2р + H2O.(Соли
уксусной кислоты называются ацетатами)
б) Реакции слабых кислот с
гидроксид-ионами
В качестве примера рассмотрим, как
реагируют с гидроксид-ионами молекулы фосфорной
(ортофосфорной) кислоты:
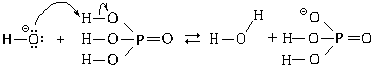
В результате реакции получаются
молекулы воды и дигидрофосфат-ионы.
Если после завершения этой реакции в растворе
остаются гидроксид-ионы, то дигидрофосфат-ионы,
являясь амфолитами, будут с ними реагировать:
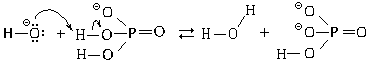
Образуются гидрофосфат-ионы, которые,
также являясь амфолитами, могут реагировать с
избытком гидроксид-ионов:
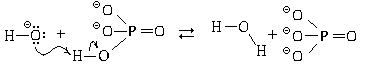 .
.
Ионные уравнения этих реакций
H3PO4 + OH
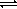 H2PO4
H2PO4 + H2O;
+ H2O;
H2PO4 + OH
+ OH
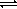 HPO42
HPO42 + H2O;
+ H2O;
HPO4 + OH
+ OH 
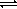 PO43
PO43 + H2O.
+ H2O.
Равновесия этих обратимых реакций
смещены вправо. В избытке раствора щелочи
(например, NaOH) все эти реакции протекают
практически необратимо, поэтому их молекулярные
уравнения обычно записывают так:
H3PO4р + NaOHр = NaH2PO4р
+ H2O;
NaH2PO4р + NaOHр = Na2HPO4р;
Na2HPO4р + NaOHр = Na3PO4р + H2O.
Если целевым продуктом этих реакций
является фосфат натрия, то можно записать и
суммарное уравнение:
H3PO4 + 3NaOH = Na3PO4 + 3H2O.
Таким образом, молекула фосфорной
кислоты, вступая в кислотно-основные
взаимодействия, может последовательно отдавать
один, два или три протона. В аналогичном процессе
молекула сероводородной кислоты (H2S) может
отдавать один или два протона, а молекула
азотистой кислоты (HNO2) - только один протон.
Соответственно, эти кислоты относят к
трехосновным, двухосновным и одноосновным.
Основность кислоты - число
протонов, которые в кислотно-основных
взаимодействиях может отдать молекула кислоты. |
Соответствующая характеристика
основания называется кислотностью.
Кислотность основания -
число гидроксид-ионов, переходящих в раствор из
одной формульной единицы основания. |
Примеры однокислотных оснований - NaOH,
KOH; примеры двукислотных оснований - Ca(OH)2,
Ba(OH)2.
Наиболее сильные из слабых кислот могут
реагировать и с гидроксид-ионами, входящими в
состав нерастворимых оснований и даже
амфотерных гидроксидов.
в) Реакции слабых кислот со слабыми
основаниями
Практически все эти реакции обратимы.
В соответствии с общим правилом равновесия в
таких обратимых реакциях смещены в сторону более
слабых кислот и более слабых оснований.
 ОСНОВНОСТЬ
КИСЛОТЫ, КИСЛОТНОСТЬ ОСНОВАНИЯ.
ОСНОВНОСТЬ
КИСЛОТЫ, КИСЛОТНОСТЬ ОСНОВАНИЯ.
 1.Составьте схемы механизмов реакций,
протекающих в водном растворе между муравьиной
кислотой
1.Составьте схемы механизмов реакций,
протекающих в водном растворе между муравьиной
кислотой 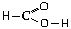 и следующими веществами: Fe2O3,
KOH и Fe(OH)3. По схемам составьте ионные и
молекулярные уравнения этих реакций.
и следующими веществами: Fe2O3,
KOH и Fe(OH)3. По схемам составьте ионные и
молекулярные уравнения этих реакций.
2.С какими из перечисленных веществ будет
реагировать в растворе сернистая кислота: LiOH, K2CO3,
Na2SO4, KCl? Составьте ионные и
молекулярные уравнения реакций.
3.Раствор какого вещества получится в результате
сливания раствора, содержащего 29,4 г фосфорной
кислоты, с раствором, содержащим 8 г гидроксида
натрия? Определите массу соли, которая может быть
выделена из этого раствора при выходе, равном 98 %.
 Реакции растворов слабых кислот с основаниями,
основными оксидами и солями.
Реакции растворов слабых кислот с основаниями,
основными оксидами и солями.
12.7. Катионные кислоты
Среди частиц, проявляющих кислотные
свойства, особое место занимают гидратированные
катионы некоторых элементов, образующих металлы.
Эти ионы появляются в растворе, например, при
растворении соответствующей соли:
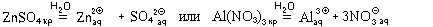
Образовавшиеся гидратированные
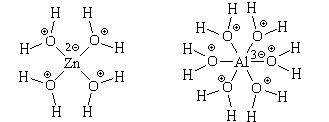
катионы представляют собой сложные частицы
состава [Zn(H2O)4]2 (ион тетрааквацинка) и
[Al(H2O)6]3
(ион тетрааквацинка) и
[Al(H2O)6]3 (ион гексаакваалюминия), в
которых атомы цинка или алюминия связаны с
атомами кислорода химическими связями,
образовавшимися по донорно-акцепторному
механизму. Структурные формулы этих частиц можно
изобразить двумя способами:
(ион гексаакваалюминия), в
которых атомы цинка или алюминия связаны с
атомами кислорода химическими связями,
образовавшимися по донорно-акцепторному
механизму. Структурные формулы этих частиц можно
изобразить двумя способами:
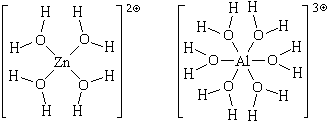
или
Причина кислотных свойств таких ионов в том,
что на атомах водорода, входящих в их состав,
образуется большой положительный частичный
заряд, значительно больший, чем на атомах
водорода в свободных молекулах воды. Поэтому эти
ионы могут отдавать протон частицам-основаниям,
а также частицам-амфолитам, в том числе и
молекулам воды. В качестве примера рассмотрим
реакцию с водой иона тетрааквацинка:
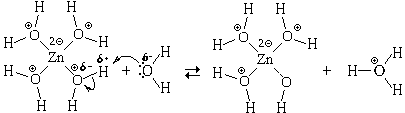
или
Образующийся ион называется ионом
моногидроксотриаквацинка, или проще - ионом
гидроксотриаквацинка. Его формула может быть
записана упрощенно - ZnOHaq  . Упрощенные формулы могут
входить и в уравнение реакции, например:
. Упрощенные формулы могут
входить и в уравнение реакции, например:
Znaq2 + 2H2O
+ 2H2O 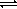 Zn OH
Zn OH aq+
H3O
aq+
H3O .
.
Так как катионные кислоты
представляют собой слабые кислоты, равновесие
этих обратимых реакции смещено в сторону
исходных веществ.
Кроме таких гидратированных катионов,
существуют гидратированные катионы и другого
типа, например: [K(H2O)n]  или [Ba(H2O)n]2
или [Ba(H2O)n]2 . В этих сложных частицах
молекулы воды связаны с центральным ионом
электростатическими силами, а число молекул воды
непостоянно. Гидратированные катионы этого типа
кислотными свойствами не обладают. К ним
относятся катионы щелочных металлов, кальция,
стронция, бария, то есть катионы элементов, атомы
которых не склонны образовывать ковалентные
связи, а также ионы серебра и некоторые другие.
. В этих сложных частицах
молекулы воды связаны с центральным ионом
электростатическими силами, а число молекул воды
непостоянно. Гидратированные катионы этого типа
кислотными свойствами не обладают. К ним
относятся катионы щелочных металлов, кальция,
стронция, бария, то есть катионы элементов, атомы
которых не склонны образовывать ковалентные
связи, а также ионы серебра и некоторые другие.
 1.Разделите перечисленные гидратированные
катионы на две группы по типу связи, удерживающей
гидратную оболочку: Cr3
1.Разделите перечисленные гидратированные
катионы на две группы по типу связи, удерживающей
гидратную оболочку: Cr3 aq, Li
aq, Li  aq,
Sr2
aq,
Sr2 aq, Be2
aq, Be2 aq, Mg2
aq, Mg2 aq, Na
aq, Na aq, Ca2
aq, Ca2 aq, Fe3
aq, Fe3 aq, Fe2
aq, Fe2 aq, Cu2
aq, Cu2 aq,
Ag
aq,
Ag aq. Какие
из этих ионов представляют собой катионные
кислоты? 2.В растворах каких из перечисленных
солей реакция среды кислотная:
aq. Какие
из этих ионов представляют собой катионные
кислоты? 2.В растворах каких из перечисленных
солей реакция среды кислотная:
а) Na2SO4, MgSO4, NaHSO4;
б) AlCl3, FeCl2, CaCl2;
в) Ca(HCO3)2, NaHCO3, Na2CO3?
3.Используя общее правило, объясните направление
смещения равновесия обратимой реакции Mg2 aq + 2H2O
aq + 2H2O  Mg OH
Mg OH  aq+ H3O
aq+ H3O .
.
4.В каком направлении сместится равновесие в этом
растворе а) при его разбавлении водой, б) при
добавлении в него раствора сильной кислоты?


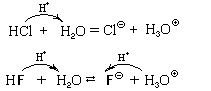



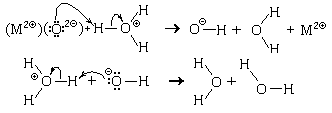
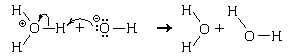

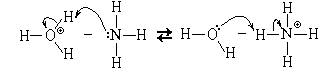 .
.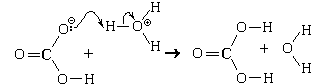
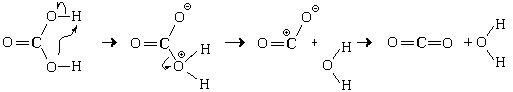

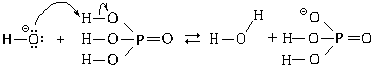
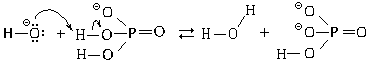
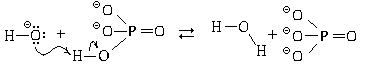 .
.

