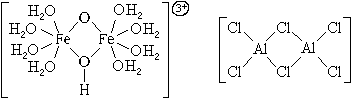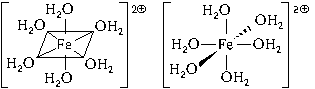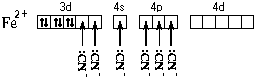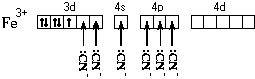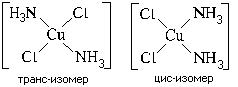С. Т. Жуков Химия-10/11класс
Глава 17.Комплексные соединения
17.1. Основные определения
В этой главе вы познакомитесь с особой группой
сложных веществ, называемых комплексными
(или координационными) соединениями.
| Комплексное соединение –
химическое вещество, в состав которого входят
комплексные частицы. |
В настоящее время строгого определения понятия
" комплексная частица" нет. Обычно
используется следующее определение.
| Комплексная частица – сложная
частица, способная к самостоятельному
существованию в кристалле или растворе,
образованная из других, более простых частиц,
также способных к самостоятельному
существованию. |
Например, гидратированный ион меди [Cu(H2O)4]2 – комплексная
частица, так как она реально существует в
растворах и некоторых кристаллогидратах,
образована из ионов Cu2
– комплексная
частица, так как она реально существует в
растворах и некоторых кристаллогидратах,
образована из ионов Cu2 и молекул H2O, молекулы воды –
реально существующие молекулы, а ионы Cu2
и молекул H2O, молекулы воды –
реально существующие молекулы, а ионы Cu2 существуют в
кристаллах многих соединений меди. Напротив, ион
SO42
существуют в
кристаллах многих соединений меди. Напротив, ион
SO42 не
является комплексной частицей, так как, хоть ионы
O2
не
является комплексной частицей, так как, хоть ионы
O2 в
кристаллах встречаются, ион S6
в
кристаллах встречаются, ион S6 в химических системах не
существует.
в химических системах не
существует.
Примеры других комплексных частиц: [Zn(OH)4]2 , [Al(H2O)6]3
, [Al(H2O)6]3 , [Cu(H2O)2Br2],
[HgI4]2
, [Cu(H2O)2Br2],
[HgI4]2 .
.
Вместе с тем к комплексным частицам относят
ионы NH4 и H3O
и H3O ,
хотя ионы H
,
хотя ионы H в химических системах не существуют.
в химических системах не существуют.
Иногда комплексными частицами называют
сложные химические частицы, все или часть связей
в которых образованы по донорно-акцепторному
механизму. В большинстве комплексных частиц так
и есть, но, например, в алюмокалиевых квасцах [K(H2O)6][Al(H2O)6]SO4
в комплексной частице [Al(H2O)6]3 связь между
атомами Al и O действительно образована по
донорно-акцепторному механизму, а в комплексной
частице [K(H2O)6]
связь между
атомами Al и O действительно образована по
донорно-акцепторному механизму, а в комплексной
частице [K(H2O)6] имеется лишь электростатическое
(ион-дипольное) взаимодействие. Подтверждение
этого – существование в железоаммонийных
квасцах аналогичной по строению комплексной
частицы [NH4(H2O)6]
имеется лишь электростатическое
(ион-дипольное) взаимодействие. Подтверждение
этого – существование в железоаммонийных
квасцах аналогичной по строению комплексной
частицы [NH4(H2O)6] , в которой между
молекулами воды и ионом NH4
, в которой между
молекулами воды и ионом NH4 возможно только
ион-дипольное взаимодействие.
возможно только
ион-дипольное взаимодействие.
По заряду комплексные частицы могут быть
катионами, анионами, а также нейтральными
молекулами. Комплексные соединения, включающие
такие частицы, могут относиться к различным
классам химических веществ (кислотам,
основаниям, солям). Примеры: (H3O)[AuCl4] –
кислота, [Ag(NH3)2]OH – основание, NH4Cl
и K3[Fe(CN)6] – соли.
| Комплексообразователь –
центральный атом комплексной частицы. |
Обычно комплексообразователь – атом элемента,
образующего металл, но это может быть и атом
кислорода, азота, серы, йода и других элементов,
образующих неметаллы. Степень окисления
комплексообразователя может быть положительной,
отрицательной или равной нулю; при образовании
комплексного соединения из более простых
веществ она не меняется.
| Лиганды – атомы или изолированные
группы атомов, располагающиеся вокруг
комплексообразователя. |
Лигандами могут быть частицы, до образования
комплексного соединения представлявшие собой
молекулы (H2O, CO, NH3 и др.), анионы (OH , Cl
, Cl , PO43
, PO43 и др.), а также катион
водорода. Различают унидентатные или
монодентатные лиганды (связанные с центральным
атомом через один из своих атомов, то есть, одной
и др.), а также катион
водорода. Различают унидентатные или
монодентатные лиганды (связанные с центральным
атомом через один из своих атомов, то есть, одной  -связью), бидентатные
(связанные с центральным атомом через два своих
атома, то есть, двумя
-связью), бидентатные
(связанные с центральным атомом через два своих
атома, то есть, двумя  -связями), тридентатные
и т. д.
-связями), тридентатные
и т. д.
Координационное число (КЧ) – число  -связей, образуемых центральным
атомом с лигандами. -связей, образуемых центральным
атомом с лигандами. |
Если лиганды унидентатные, то координационное
число равно числу таких лигандов.
КЧ зависит от электронного строения
центрального атома, от его степени окисления,
размеров центрального атома и лигандов, условий
образования комплексного соединения,
температуры и других факторов. КЧ может
принимать значения от 2 до 12. Чаще всего оно равно
шести, несколько реже – четырем.
Существуют комплексные частицы и с несколькими
центральными атомами.
Внутренняя сфера комплексного
соединения – центральный атом со связанными с
ним лигандами, то есть, собственно комплексная
частица.
Внешняя сфера комплексного соединения –
остальные частицы, связанные с комплексной
частицей ионной или межмолекулярными связями,
включая водородные. |
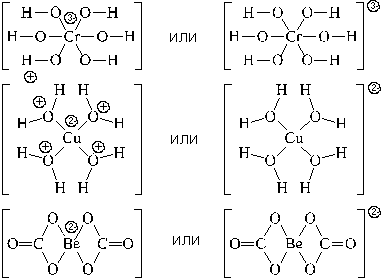
Используются два вида структурных формул
комплексных частиц: с указанием формального
заряда центрального атома и лигандов, или с
указанием формального заряда всей комплексной
частицы. Примеры:
Для характеристики формы комплексной частицы
используется представление о координационном
полиэдре (многограннике).
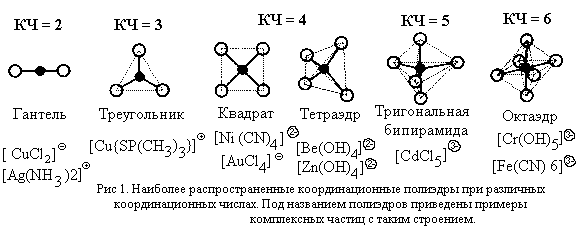
| Координационный полиэдр –
воображаемый многогранник, в центре которого
расположен атом-комплексообразователь, а в
вершинах – атомы лигандов, непосредственно
связанные с комплексообразователем. |
К координационным полиэдрам относят также
квадрат (КЧ = 4), треугольник (КЧ = 3) и гантель (КЧ = 2),
хотя эти фигуры и не являются многогранниками.
Примеры координационных полиэдров и имеющих
соответствующую форму комплексных частиц для
наиболее распространенных значений КЧ приведены
на рис. 1.
17.2. Классификация комплексных
соединений
Как химические вещества комплексные
соединения делятся на ионные (их иногда называют ионогенными)
и молекулярные (неионогенные) соединения.
Ионные комплексные соединения содержат
заряженные комплексные частицы – ионы – и
являются кислотами, основаниями или солями (см. §
1). Молекулярные комплексные соединения состоят
из незаряженных комплексных частиц (молекул),
например: [Fe(CO)5] или [Cr(C6H6)2]
– отнесение их к какому-либо основному классу
химических веществ затруднительно.
Входящие в состав комплексных соединений
комплексные частицы довольно разнообразны.
Поэтому для их классификации используется
несколько классификационных признаков: число
центральных атомов, тип лиганда, координационное
число и другие.
По числу центральных атомов комплексные
частицы делятся на одноядерные и
многоядерные. Центральные атомы многоядерных
комплексных частиц могут быть связаны между
собой либо непосредственно, либо через лиганды. И
в том, и в другом случае центральные атомы с
лигандами образуют единую внутреннюю сферу
комплексного соединения:
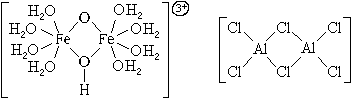
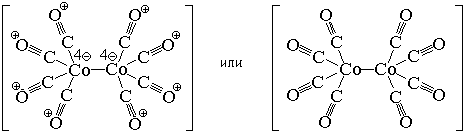
По типу лигандов комплексные частицы делятся
на
1) Аквакомплексы, то есть комплексные
частицы, в которых в качестве лигандов
присутствуют молекулы воды. Более или менее
устойчивы катионные аквакомплексы [M(H2O)n]m , анионные
аквакомплексы неустойчивы. Все кристаллогидраты
относятся к соединениям, содержащим
аквакомплексы, например:
, анионные
аквакомплексы неустойчивы. Все кристаллогидраты
относятся к соединениям, содержащим
аквакомплексы, например:
Mg(ClO4)2.6H2O на самом деле
[Mg(H2O)6](ClO4)2;
BeSO4.4H2O на самом деле [Be(H2O)4]SO4;
Zn(BrO3)2.6H2O на самом деле [Zn(H2O)6](BrO3)2;
CuSO4.5H2O на самом деле [Cu(H2O)4]SO4.H2O.
2) Гидроксокомплексы, то есть комплексные
частицы, в которых в качестве лигандов
присутствуют гидроксильные группы, которые до
вхождения в состав комплексной частицы были
гидроксид-ионами, например: [Zn(OH)4]2 , [Cr(OH)6]3
, [Cr(OH)6]3 , [Pb(OH)3]
, [Pb(OH)3] .
.
Гидроксокомплексы образуются из
аквакомплексов, проявляющих свойства катионных
кислот:
[Zn(H2O)4]2 + 4OH
+ 4OH = [Zn(OH)4]2
= [Zn(OH)4]2 + 4H2O
+ 4H2O
3) Аммиакаты, то есть комплексные частицы, в
которых в качестве лигандов присутствуют группы
NH3 (до образования комплексной частицы –
молекулы аммиака), например: [Cu(NH3)4]2 , [Ag(NH3)2]
, [Ag(NH3)2] , [Co(NH3)6]3
, [Co(NH3)6]3 .
.
Аммиакаты также могут быть получены из
аквакомплексов, например:
[Cu(H2O)4]2 + 4NH3 = [Cu(NH3)4]2
+ 4NH3 = [Cu(NH3)4]2 + 4 H2O
+ 4 H2O
Окраска раствора в этом случае меняется с
голубой до ультрамариновой.
4) Ацидокомплексы, то есть комплексные
частицы, в которых в качестве лигандов
присутствуют кислотные остатки как
бескислородных, так и кислородсодержащих кислот
(до образования комплексной частицы – анионы,
например: Cl ,
Br
,
Br , I
, I , CN
, CN , S2
, S2 , NO2
, NO2 , S2O32
, S2O32 , CO32
, CO32 , C2O42
, C2O42 и т. п.).
и т. п.).
Примеры образования ацидокомплексов:
Hg2 + 4I
+ 4I = [HgI4]2
= [HgI4]2
AgBr + 2S2O32 = [Ag(S2O3)2]3
= [Ag(S2O3)2]3 + Br
+ Br
Последняя реакция используется в фотографии
для удаления с фотоматериалов
непрореагировавшего бромида серебра.
(При проявлении фотопленки и фотобумаги
незасвеченная часть бромида серебра,
содержащегося в фотографической эмульсии, не
восстанавливается проявителем. Для ее удаления
и используют эту реакцию ( процесс носит
название "фиксирования", так как
неудаленный бромид серебра в дальнейшем на свету
постепенно разлагается, разрушая изображение)
5) Комплексы, в которых лигандами являются атомы
водорода, делятся на две совершенно разные
группы: гидридные комплексы и комплексы,
входящие в состав ониевых соединений.
При образовании гидридных комплексов – [BH4] , [AlH4]
, [AlH4] , [GaH4]
, [GaH4] – центральный
атом является акцептором электронов, а донором –
гидридный ион. Степень окисления атомов водорода
в этих комплексах равна –1.
– центральный
атом является акцептором электронов, а донором –
гидридный ион. Степень окисления атомов водорода
в этих комплексах равна –1.
В ониевых комплексах центральный атом является
донором электронов, а акцептором – атом водорода
в степени окисления +1. Примеры: H3O или [OH3]
или [OH3] – ион оксония, NH4
– ион оксония, NH4 или [NH4]
или [NH4] – ион аммония.
Кроме того существуют и замещенные производные
таких ионов: [N(CH3)4]
– ион аммония.
Кроме того существуют и замещенные производные
таких ионов: [N(CH3)4] – ион тетраметиламмония, [As(C6H5)4]
– ион тетраметиламмония, [As(C6H5)4] – ион
тетрафениларсония, [OH(C2H5)2]
– ион
тетрафениларсония, [OH(C2H5)2] – ион
диэтилоксония и т. п.
– ион
диэтилоксония и т. п.
6) Карбонильные комплексы – комплексы, в
которых в качестве лигандов присутствуют группы
CO (до образования комплекса – молекулы
монооксида углерода), например: [Cr(CO)6], [Fe(CO)5],
[Ni(CO)4] и др.
7) Анионгалогенатные комплексы – комплексы
типа [I(I)2] .
.
По типу лигандов выделяют и другие классы
комплексных частиц. Кроме того существуют
комплексные частицы с различными по типу
лигандами; простейший пример –
аква-гидроксокомплекс [Zn(H2O)3(OH)] .
.
17.3. Основы номенклатуры
комплексных соединений
Формула комплексного соединения составляется
также, как и формула любого ионного вещества: на
первом месте записывается формула катиона, на
втором – аниона.
Формула комплексной частицы записывается в
квадратных скобках в следующей
последовательности: на первом месте ставится
символ элемента-комплексообразователя, далее –
формулы лигандов, бывших до образования
комплекса катионами, затем – формулы лигандов,
бывших до образования комплекса нейтральными
молекулами, и после них – формулы лигандов,
бывших до образования комплекса анионами.
Название комплексного соединения строится
также, как и название любой соли или основания
(комплексные кислоты называются солями водорода
или оксония). В название соединения входит
название катиона и название аниона.
В название комплексной частицы входит название
комплексообразователя и названия лигандов
(название записывается в соответствии с
формулой, но справа налево. Для
комплексообразователей в катионах используются
русские названия элементов, а в анионах –
латинские.
Названия наиболее распространенных лигандов:
| H2O – аква |
Cl  – хлоро
– хлоро |
SO42 – сульфато – сульфато |
OH – гидроксо
– гидроксо |
| CO – карбонил |
Br  – бромо
– бромо |
CO32 – карбонато – карбонато |
H – гидридо
– гидридо |
| NH3 – аммин |
NO2 – нитро – нитро |
CN – циано
– циано |
NO – нитрозо
– нитрозо |
| NO – нитрозил |
O2 – оксо
– оксо |
NCS – тиоцианато
– тиоцианато |
H+I – гидро |
Примеры названий комплексных катионов:
[Zn(H2O)4]2 – ион тетрааквацинка – ион тетрааквацинка |
[Fe(H2O)5Cl]2 – ион хлоропентаакважелеза(III) – ион хлоропентаакважелеза(III) |
[Ag(NH3)2] – ион диамминсеребра(I) – ион диамминсеребра(I) |
[Al(H2O)4(OH)2] – ион
дигидроксотетраакваалюминия – ион
дигидроксотетраакваалюминия |
[Cr(H2O)6]3 – ион гексааквахрома(III) – ион гексааквахрома(III) |
[Co(NH3)5SO3] – ион
сульфитопентаамминкобальта(III) – ион
сульфитопентаамминкобальта(III) |
Примеры названий комплексных анионов:
[Zn(OH)4]2 – тетрагидроксоцинкат-ион
– тетрагидроксоцинкат-ион
[Ag(S2O3)2]3 – ди(тиосульфато)аргентат(I)-ион
– ди(тиосульфато)аргентат(I)-ион
[Cr(CN)6]3 – гексацианохромат(III)-ион
– гексацианохромат(III)-ион
[Al(H2O)2(OH)4] –
тетрагидроксодиакваалюминат-ион
–
тетрагидроксодиакваалюминат-ион
[Co(NH3)2(NO2)4] –
тетранитродиамминкобальтат(III)-ион
–
тетранитродиамминкобальтат(III)-ион
[Fe(H2O)(CN)5]3 – пентацианоакваферрат(II)-ион
– пентацианоакваферрат(II)-ион
Примеры названий нейтральных комплексных
частиц:
| [Fe(CO)5] – пентакарбонилжелезо |
[Cr(C6H6)2] – дибензолхром |
| [Co(NH3)Cl3] –
трихлороамминкобальт |
[Pt(NH3)2Br2] –
дибромодиамминплатина |
Более подробные номенклатурные правила
приводятся в справочниках и специальных
пособиях.
17.4. Химическая связь в комплексных
соединениях и их строение
В кристаллических комплексных соединениях с
заряженными комплексами связь между комплексом
и внешнесферными ионами ионная, связи между
остальными частицами внешней сферы –
межмолекулярные (в том числе и водородные). В
молекулярных комплексных соединениях связь
между комплексами межмолекулярная.
В большинстве комплексных частиц между
центральным атомом и лигандами связи
ковалентные. Все они или их часть образованы по
донорно-акцепторному механизму (как следствие –
с изменением формальных зарядов). В наименее
прочных комплексах (например, в аквакомплексах
щелочных и щелочноземельных элементов, а также
аммония) лиганды удерживаются
электростатическим притяжением. Связь в
комплексных частицах часто называют
донорно-акцепторной или координационной связью.
Рассмотрим ее образование на примере
аквакатиона железа(II). Этот ион образуется по
реакции:
FeCl2кр + 6H2O = [Fe(H2O)6]2 + 2Cl
+ 2Cl
Электронная формула атома железа – 1s22s22p63s23p64s23d6.
Составим схему валентных подуровней этого атома:

При образовании двухзарядного иона атом железа
теряет два 4s-электрона:
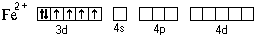
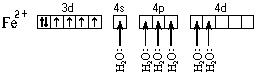
Ион железа акцептирует шесть
электронных пар атомов кислорода шести молекул
воды на свободные валентные орбитали:
Образуется комплексный катион, химическое
строение которого можно выразить одной из
следующих формул:
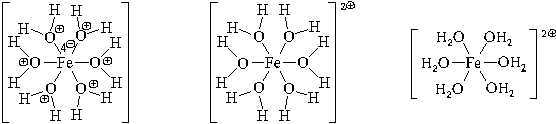
Пространственное строение этой частицы
выражается одной из пространственных формул:
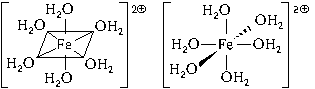
Форма координационного полиэдра – октаэдр. Все
связи Fe-O одинаковые. Предполагается sp3d2-гибридизация
АО атома железа. Магнитные свойства комплекса
указывают на наличие неспаренных электронов.
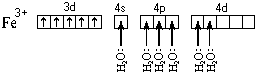
Если FeCl2 растворять в растворе,
содержащем цианид-ионы, то протекает реакция
FeCl2кр + 6CN = [Fe(CN)6]4
= [Fe(CN)6]4 + 2Cl
+ 2Cl .
.
Тот же комплекс получается и при добавлении к
раствору FeCl2 раствора цианида калия KCN:
[Fe(H2O)6]2 + 6CN
+ 6CN = [Fe(CN)6]4
= [Fe(CN)6]4 + 6H2O .
+ 6H2O .
Это говорит о том, что цианидный комплекс
прочнее аквакомплекса. Кроме того магнитные
свойства цианидного комплекса указывают на
отсутствие неспаренных электронов у атома
железа. Все это связано с несколько иным
электронным строением этого комплекса:
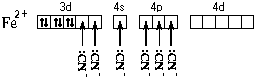
Более " сильные" лиганды CN образуют более прочные
связи с атомом железа, выигрыша в энергии хватает
на то, чтобы " нарушить" правило Хунда и
освободить 3d-орбитали для неподеленных пар
лигандов. Пространственное строение цианидного
комплекса такое же, как и аквакомплекса, но тип
гибридизации другой – d2sp3.
образуют более прочные
связи с атомом железа, выигрыша в энергии хватает
на то, чтобы " нарушить" правило Хунда и
освободить 3d-орбитали для неподеленных пар
лигандов. Пространственное строение цианидного
комплекса такое же, как и аквакомплекса, но тип
гибридизации другой – d2sp3.
" Сила" лиганда зависит прежде всего от
электронной плотности облака неподеленной пары
электронов, то есть, она увеличивается с
уменьшением размера атома, с уменьшением
главного квантового числа, зависит от типа
гибридизации ЭО и от некоторых других факторов.
Важнейшие лиганды можно выстроить в ряд по
возрастанию их " силы" (своеобразный " ряд
активности" лигандов), этот ряд называется
спектрохимическим рядом лигандов:
I ;
Br ;
Br  ; :SCN ; :SCN , Cl , Cl  , F , F , OH , OH , H2O; :NCS , H2O; :NCS , NH3; SO3S:2 , NH3; SO3S:2 ; :CN ; :CN , CO , CO |
Для комплексов [Fe(H2O)6]3 и [Fe(CN)6]3
и [Fe(CN)6]3 схемы
образования выглядят следующим образом:
схемы
образования выглядят следующим образом:
Для комплексов с КЧ = 4 возможны две структуры:
тетраэдр (в случае sp3-гибридизации),
например, [Zn(H2O)4]2 , и плоский квадрат (в случае dsp2-гибридизации),
например, [Cu(NH3)4]2
, и плоский квадрат (в случае dsp2-гибридизации),
например, [Cu(NH3)4]2 .
.
17.5. Химические свойства комплексных
соединений
Для комплексных соединений прежде всего
характерны те же свойства, что и для обычных
соединений тех же классов (соли, кислоты,
основания).
Если комплексное соединение кислота, то это
сильная кислота, если основание, то и основание
сильное. Эти свойства комплексных соединений
определяются только наличием ионов H3O или OH
или OH . Кроме этого
комплексные кислоты, основания и соли вступают в обычные реакции обмена, например:
. Кроме этого
комплексные кислоты, основания и соли вступают в обычные реакции обмена, например:
[Cu(NH3)4]SO4 + BaCl2 = BaSO4 + [Cu(NH3)4]Cl2
+ [Cu(NH3)4]Cl2
FeCl3 + K4[Fe(CN)6] = Fe4[Fe(CN)6]3
 + 3KCl
+ 3KCl
Последняя из этих реакций используется в
качестве качественной реакции на ионы Fe3 . Образующееся
нерастворимое вещество ультрамаринового цвета
называют " берлинской лазурью"
[систематическое название – гексацианоферрат(II)
железа(III)-калия].
. Образующееся
нерастворимое вещество ультрамаринового цвета
называют " берлинской лазурью"
[систематическое название – гексацианоферрат(II)
железа(III)-калия].
Кроме этого в реакцию может вступать и сама
комплексная частица, причем, тем активнее, чем
она менее устойчива. Обычно это реакции
замещения лигандов, протекающие в растворе,
например:
[Cu(H2O)4]2 + 4NH3 = [Cu(NH3)4]2
+ 4NH3 = [Cu(NH3)4]2 + 4H2O,
+ 4H2O,
а также кислотно-основные реакции типа
[Zn(OH)4]2 + 2H3O
+ 2H3O = [Zn(H2O)2(OH)2]
= [Zn(H2O)2(OH)2] + 2H2O
+ 2H2O
[Zn(H2O)4]2 + 2OH
+ 2OH = [Zn(H2O)2(OH)2]
= [Zn(H2O)2(OH)2] + 2H2O
+ 2H2O
Образующийся в этих реакциях [Zn(H2O)2(OH)2]
после выделения и высушивания превращается в
гидроксид цинка:
[Zn(H2O)2(OH)2] = Zn(OH)2 +
2H2O
Последняя реакция – простейший пример
разложения комплексного соединения. В данном
случае она протекает при комнатной температуре.
Другие комплексные соединения разлагаются при
нагревании, например:
[Cu(NH3)4]SO4.H2O = CuSO4
+ 4NH3 + H2O (выше 300 oС)
4K3[Co(NO2)6] = 12KNO2 + 4CoO + 4NO + 8NO2
(выше 200 oС)
K2[Zn(OH)4] = K2ZnO2 + 2H2O
(выше 100 oС)
Для оценки возможности протекания реакции
замещения лигандов можно использовать
спектрохимический ряд, руководствуясь тем, что
более сильные лиганды вытесняют из внутренней
сферы менее сильные.
17.6. Изомерия комплексных
соединений
Изомерия комплексных соединений связана
1) с возможным различным расположением лигандов и
внешнесферных частиц,
2) с различным строением самой комплексной
частицы.
К первой группе относится гидратная (в
общем случае сольватная) и ионизационная
изомерия, ко второй – пространственная и оптическая.
Гидратная изомерия связана с возможностью
различного распределения молекул воды во
внешней и внутренней сферах комплексного
соединения, например: [Cu(H2O)2Br2]
(цвет красно-коричневый) и [Cu(H2O)4]Br2
(цвет голубой).
Ионизационная изомерия связана с возможностью
различного распределения ионов во внешней и
внутренней сфере, например: [Co(NH3)5Br]SO4
(пурпурного цвета) и [Co(NH3)5SO4]Br
(красного цвета). Первое из этих соединений
образует осадок, реагируя с раствором хлорида
бария, а второе – с раствором нитрата серебра.
Пространственная (геометрическая) изомерия,
иначе называемая цис-транс изомерией, характерна
для квадратных и октаэдрических комплексов (для
тетраэдрических невозможна). Пример: цис-транс
изомерия квадратного комплекса [Pt(NH3)2Cl2]
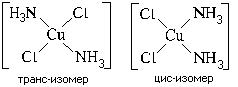
Оптическая (зеркальная) изомерия по своей сути
не отличается от оптической изомерии в
органической химии и характерна для
тетраэдрических и октаэдрических комплексов
(для квадратных невозможна).
 Комплексное
(координационное) соединение, комплексная
частица, комплексообразователь, лиганды,
дентатность лиганда, координационное число,
координационный полиэдр, внутренняя сфера,
внешняя сфера, аквакомплексы, гидроксокомплексы,
аммиакаты, ацидокомплексы, гидридные комплексы,
карбонильные комплексы, анионгалогенатные
комплексы, спектрохимический ряд лигандов
Комплексное
(координационное) соединение, комплексная
частица, комплексообразователь, лиганды,
дентатность лиганда, координационное число,
координационный полиэдр, внутренняя сфера,
внешняя сфера, аквакомплексы, гидроксокомплексы,
аммиакаты, ацидокомплексы, гидридные комплексы,
карбонильные комплексы, анионгалогенатные
комплексы, спектрохимический ряд лигандов
 1.В следующих комплексных соединениях укажите
центральный атом, лиганды, внутреннюю и внешнюю
сферы; определите заряд комплексной частицы,
степень окисления центрального атома и его
координационное число. Назовите эти соединения и
укажите к какому классу комплексов относятся
комплексные частицы, входящие в состав
соединений и к какому классу химических веществ
относится каждое из этих соединений.
1.В следующих комплексных соединениях укажите
центральный атом, лиганды, внутреннюю и внешнюю
сферы; определите заряд комплексной частицы,
степень окисления центрального атома и его
координационное число. Назовите эти соединения и
укажите к какому классу комплексов относятся
комплексные частицы, входящие в состав
соединений и к какому классу химических веществ
относится каждое из этих соединений.
а) [Zn(NH3)4](NO3)2;
б) [Cr(CO)6]; в) K3[Co(NO3)6].H2O;
г) Ca[Cr(NH3)2(NCS)4]2; д) [Cu(NH3)4]SO4.H2O;
е) [K(H2O)6][Cr(H2O)6](SO4)2;
ж) [H3O]3[FeCl6].H2O; и) K[Ag(CN)2];
к) Na3[FeF6]; л) Na[Sb(OH)6]; м) K2[HgI4];
н) [Cr(H2O)6]Cl3; п) [Cr(H2O)4Cl2]Cl.2H2O;
р) Cs[ICl4]; с) H[AuCl4]; т) K[I(I)2]; у)
Li[AlH4]; ф) [Cu(NH3)4](OH)2; х) [N(CH3)4]Cl;
ц) [P(C6H5)4][B(C6H5)4];
?) [H3O][AuBr4].4H2O; o) [PCl4][PCl6].
2.Составьте формулы следующих комплексных
соединений:
гексахлоропалладат(IV) аммония;
дихлороаргентат(I) цезия;
гидроксотрихлороаурат(III) оксония;
гексабромоиридат(III) калия;
сульфат дихлоротетраамминкобальта(III);
тетрагидридоборат цезия;
гексакарбонилхром.
3.Молекула гидразина способна присоединять один
или два протона и образовывать соли с сильными
кислотами. Составьте структурные формулы двух
разных сульфатов гидразиния.
4.Если возможно присоединение протона к молекуле
воды с образованием иона оксония, то почему не
происходит присоединение второго протона с
использованием второй неподеленной пары
электронов атома кислорода?
5.Объясните, почему невозможна следующая реакция:
Fe3 + 6H3O
+ 6H3O = [Fe(H3O)6]9
= [Fe(H3O)6]9 .
.
6.Из водного раствора, содержащего 0,04 моля
комплексного соединения состава PtCl4.3NH3,
при добавлении нитрата серебра осаждается 0,04
моля хлорида серебра. По результатам этого опыта
составьте координационную (предельно упрощенную
структурную) формулу соединения.
7.Из водного раствора, содержащего 0,2 моля
комплексного соединения состава CoBr3.5NH3,
при добавлении избытка раствора нитрата серебра
осаждается 0,4 моля бромида серебра. По
результатам этого опыта составьте
координационную формулу соединения.
8.Составьте схему валентных орбиталей
центрального атома, определите тип гибридизации
АО этого атома и строение следующих комплексных
частиц:
а) [Pb(OH)3] ;
б) [Sb(OH)6]
;
б) [Sb(OH)6] ;
в) [Zn(CN)4]2
;
в) [Zn(CN)4]2 ;
г) [Al(H2O)6]3
;
г) [Al(H2O)6]3 ; д) [Zn(H2O)4]2
; д) [Zn(H2O)4]2 ; е) [Fe(CN)6]3
; е) [Fe(CN)6]3 ; ж) [Mn(CN)6]3
; ж) [Mn(CN)6]3 ; и) [Mg(H2O)6]2
; и) [Mg(H2O)6]2 ; к) [Be(H2O)4]2
; к) [Be(H2O)4]2 ; л) [Ag(NH3)2]
; л) [Ag(NH3)2] ; м) [Cu(NH3)2]
; м) [Cu(NH3)2] ; н) [Au(CN)2]
; н) [Au(CN)2] ; п) [Cu(NH3)4]2
; п) [Cu(NH3)4]2 ; р) [MnCl6]2
; р) [MnCl6]2 ; с) [Cu(CN)2]
; с) [Cu(CN)2] ; т) [SnF3]
; т) [SnF3] ; у) [Be(OH)4]2
; у) [Be(OH)4]2 ; ф) [Sn(OH)6]2
; ф) [Sn(OH)6]2 ; х) [Fe(H2O)6]3
; х) [Fe(H2O)6]3 ; ц) [Ni(H2O)6]2
; ц) [Ni(H2O)6]2 ; ч) [Au(CN)4]
; ч) [Au(CN)4] .
.
9.Определите общее число возможных изомеров
комплексного соединения CrCl3.5H2O,
составьте их формулы и названия.
10.Осуществите следующие превращения:
а) CuSO4 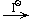 CuI
CuI 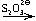 Na3[Cu(S2O3)2]
Na3[Cu(S2O3)2]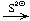 Cu2S;
Cu2S;
б) Cu2O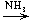 [Cu(NH3)2]OH
[Cu(NH3)2]OH 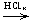 H[CuCl2];
H[CuCl2];
в) CuSO4 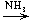 (CuOH)2SO4
(CuOH)2SO4
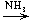 [Cu(NH3)4]SO4
[Cu(NH3)4]SO4
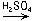 CuSO4;
CuSO4;
г) AgNO3  AgCl
AgCl  [Ag(NH3)2]Cl
[Ag(NH3)2]Cl 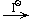 AgI
AgI 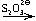 Na3[Ag(S2O3)2]
Na3[Ag(S2O3)2]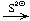 Ag2S;
Ag2S;
д) FeCl3 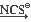 Na3[Fe(H2O)4(NCS)2]
Na3[Fe(H2O)4(NCS)2]
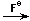 Na3[FeF6];
Na3[FeF6];
е) CoCl2 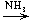 [Co(NH3)6]
[Co(NH3)6]
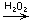 [Co(NH3)6]Cl2(OH);
[Co(NH3)6]Cl2(OH);
ж) Hg(NO3)2 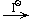 HgI2
HgI2
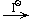 [HgI4]2
[HgI4]2
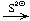 HgS.
HgS.
 Опыт
1. Образование аквакомплекса. 1 микрошпатель
безводного сульфата меди поместить в пробирку и
по каплям добавить воду. Наблюдать происходящие
изменения. Составить химические уравнения
протекающих процессов.
Опыт
1. Образование аквакомплекса. 1 микрошпатель
безводного сульфата меди поместить в пробирку и
по каплям добавить воду. Наблюдать происходящие
изменения. Составить химические уравнения
протекающих процессов.
Опыт 2. разрушение аквакомплекса. 1
микрошпатель гептагидрата сульфата никеля
поместить в пробирку. Пробирку закрепить в
штативе и сначала осторожно, а затем интенсивно
нагреть на открытом пламени. Отметить изменения
цвета соли. Зная, что на первом этапе удаляется
одна молекула воды, а на втором шесть, составить,
структурную формулу исходного соединения.
Опыт 3. Образование аммиакатов. К раствору
сульфата меди, полученному в первом опыте,
добавить 5 - 6 капель раствора аммиака. Наблюдать
изменение окраски. То же проделать с раствором
сульфата никеля. Составить ионные уравнения
реакции.
Опыт 4. Разрушение аммиаката. К раствору,
содержащему аммиакат меди, полученный в
предыдущем опыте, добавить несколько капель
разбавленной серной кислоты до изменения
окраски раствора. Составит уравнения реакций и
объяснить происходящие изменения.
Опыт 5. Образование и разрушение
гидроксокомплекса. K ?anoai?o noee oeiea (3-4 капли)
добавить по каплям ?anoaвор щелочи. Наблюдать
образование и дальнейшее растворение осадка.
Затем в полученный раствор по каплям добавить
соляную кислоту до растворения первоначально
выпадающего осадка. Составит уравнения реакций и
объяснить происходящие изменения.
Опыт 6. Получение ацидокомплексов. К 2-3
каплям раствора хлорида железа(III) добавить ii eaieyi
8 eaiaeu ?anoai?a oeioeaiaoa (роданида) аммония. Затем
добавить раствор фторида натрия до
обесцвечивания. Составить уравнения реакций и
объяснить изменение цвета раствора.
Опыт 7. Получение полигалогенида. 2-3
кристаллика йода поместить в пробирку и добавить
в нее 2 капли воды. Что происходит? Добавить в
пробирку 5-6 капель раствора йодида калия и
перемешать. Наблюдать происходящие изменения.
оставить уравнение реакции.