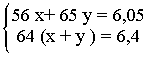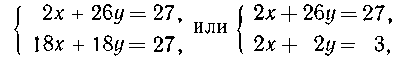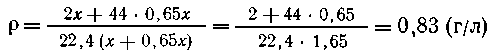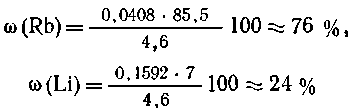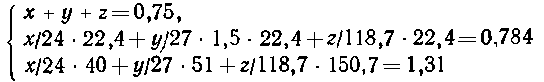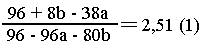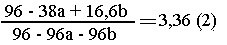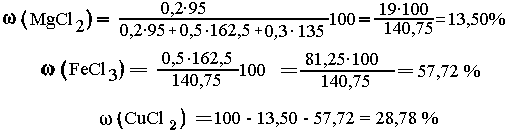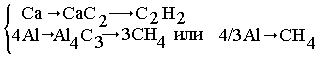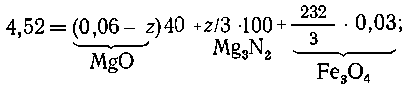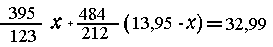Сорокин
В.В., Загорский В.В., Свитанько И.В.Задачи химических олимпиад.
В
практических работах достаточно редко расчеты приходится вести только по одной
конкретной химической реакции и по одному исходному веществу, масса которого
известна. Значительно чаще в производственных процессах (и реальной лабораторной
практике) в реакции участвует смесь исходных веществ, каждое из которых вступает
в свою химическую реакцию. Возникает задача - на основе суммарной массы образующихся
продуктов определить массу какого-либо компонента смеси. Поэтому следующий параграф
посвящен расчетам на основе химических процессов, включающих в себя несколько
параллельных (одновременно протекающих) химических реакций.
Подавляющее
большинство задач, которые обычно принято называть "задачи на смеси",
включают две параллельные реакции двух исходных веществ (точнее, смеси из двух
веществ), идущих с образованием двух продуктов реакции.
Представим
эти две химические реакции в виде следующих общих схем:
aA
+ bB  cC + dD, (1)
cC + dD, (1)
eE + fF  gG + hH, (2)
gG + hH, (2)
где А, В,
С, D, Е, F, G и Н - формулы химических веществ; а, b, с, d, e, f, g, h -
соответствующие стехиометрические коэффициенты в уравнениях (1) и (2).
В условии
задачи задаются масса исходной смеси веществ А и Е (обозначим ее т1)
и масса продуктов реакции - веществ С и G (обозначим ее т2).
Требуется определить массу одного из компонентов исходной смеси (например, вещества
А).При решении задачи массу можно выражать либо в граммах, либо в молях.
Разберем общее решение задачи, когда масса выражена в граммах. Запишем относительные
молекулярные массы всех необходимых для решения задачи веществ: М(А), М(Е),
М(С) и M(G). Далее выразим одну из масс смесей, например т2,
через т1 и массу искомого компонента т(А), т.
е. составим уравнение m2= f(т1, m(A)).Получим
значение m(С) через m (А) согласно уравнению (1) из пропорции
m(А)
 m(С),
m(С),
аМ(А)  сМ(С),
сМ(С),
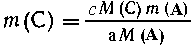
аналогично
из уравнения (2) получим выражение для
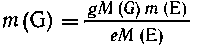 ,причем
по условиям задачи m(Е) = m1 - m(А).
,причем
по условиям задачи m(Е) = m1 - m(А).
Таким образом,
m2 можно выразить через m1 и
m(A):
|
m(C) + m(G) = m2,
или
|
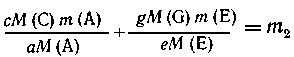 |
Получим уравнение
(3) с одним неизвестным - m(А). Это уравнение решить в принципе уже
не трудно, однако все необходимые арифметические выкладки весьма громоздки.
Значительно
проще вычисления, когда масса выражается в молях; рассмотрим решение такой задачи
также в общем виде. Суть решения сводится к тому, что, обозначив количества
веществ А и Е через "x" и "у" моль соответственно, необходимо
составить два уравнения с двумя неизвестными, выразив m1
= f(x,у) из условия, a m2 = f(x, у) по уравнениям реакций.
В первом уравнении
отражается условие задачи: масса А есть хМ(А), масса Е - уМ(Е), их
сумма - m1, т. е.
xM(A)
+ yM(E) = m1 (4)
Во втором
уравнении необходимо выразить количества С и соответственно через "x"
и "y" по уравнению (1):
| из а моль А образуется с моль
С, |
| из х моль - " - - - " -
- - "- сх/а моль С. |
По уравнению
(2):
| из е моль Е образуется g моль
G, |
| из у моль Е - " -- - " -
-" g у/е моль G. |
Таким образом,
из выведенных соотношений имеем, что вещества С получено сх/а моль, или
схМ(С)/а г, а вещества G получено gy/e моль, или guM(G)/e
г. В сумме получим массу m2:
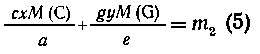
Выведенные
уравнения (4) и (5) представляют собой систему, которая обычно решается значительно
быстрее, чем ранее выведенное уравнение (3). Следует отметить, что в любом случае
решение задачи в молях предпочтительнее решения задачи в граммах. Кроме того,
на практике чаще всего встречаются задачи, когда вещества С и G (см. уравнения
(1) и (2)) представляют собой одно и то же вещество (например, газ либо осадок).
Рассмотрим
теперь примеры конкретных химических задач и их решения в граммах и молях.
Пример
1. Амальгаму натрия и алюминия массой 5,48 г обработали избытком соляной
кислоты. При этом выделилось 1,12 л водорода (н. у.). Нерастворенное вещество
отделили от раствора и взвесили. Его масса составила 4,02 г. Определить массовый
состав амальгамы (в процентах).
а. Решение
(в граммах).
2Na + 2HCl
= 2NaCl + H2 ; (1)
; (1)
2Аl + 6НС1 = 2АlСl3 + 3Н2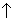 . (2)
. (2)
Остаток -
ртуть (4,02 г).
Масса натрия
и алюминия составляет 5,48-4,02 = 1,46 г. Пусть амальгама содержит х
г натрия, (1,46 - х) г алюминия. Тогда в реакции (1) выделяется
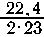 х л Н2, а
в реакции (2)
х л Н2, а
в реакции (2)
Всего 1,12
л Н2. Запишем общее уравнение
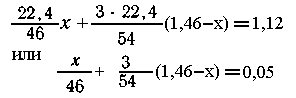
отсюда х =
0,92 г Na, 1,46 - х = 0,54 г А1.
Состав амальгамы:
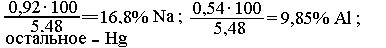
б. Решение
(в молях). Пусть было х моль Na, у моль Аl, или 23x; г Na,
27у г А1. Учитывая, что масса натрия и алюминия равна 1,46 г (5,48
г амальгамы - 4,02 г Hg), запишем общее уравнение:
23x
+ 27у= 1,46 (г).
По уравнению
(1) 2 моль натрия дают 1 моль водорода, х моль дают х/2 моль Н2,
или 11l,2x л Н2. По уравнению (2) 2 моль Al дают 3 моль Н2,
у моль А1 - 1,5 моль Н2, или 33,6y л Н2.
Суммарно водорода
выделилось 1,12 л, таким образом,
11,2x
+ 33,6y = 1,12 (л).
Теперь имеем
систему двух уравнений с двумя неизвестными:
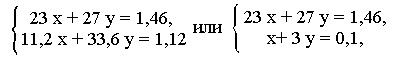
отсюда x =
0,04, или 0,92 г Na; у = 0,02, или 0,54 г А1; далее как в решении (а)
находим массовый состав амальгамы.
Пример
2. Смесь цинка и безводного нитрата цинка прокалили на воздухе, ее
масса при этом не изменилась. Определите массовые доли компонентов смеси.
Решение.
При прокаливании происходят реакции:
| 2Zn + O2 = 2ZnO; |
2Zn (NO3)2 = 2ZnO +
4NO2 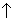 + O2 + O2
 . . |
| Mr(Zn) = 65; Mr(ZnO)
= 81; Mr(Zn(NO3)2) = 189. |
Пусть масса
цинка в смеси - m1 а масса нитрата цинка - m2. При окислении
Zn образуется (81/65) m1 г ZnO. При разложении нитрата получается
(81/189) m2 г ZnO. По условию задачи масса смеси после прокаливания
не изменяется, следовательно:
I,24m1
+ 0,43m2 = m1 + m2, откуда m1
= 2,37m2. Таким образом, массовая доля нитрата цинка в смеси
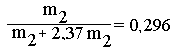 или 29,6 %. Массовая доля цинка 70,4 %.
или 29,6 %. Массовая доля цинка 70,4 %.
Пример
3. Водный раствор 3,88 г смеси муравьиного и уксусного альдегидов обработали
избытком аммиачного раствора оксида серебра. Выпавший при этом осадок отфильтровали,
промыли водой и полностью растворили в концентрированной азотной кислоте. При
этом получилось 9,856 л газа (н. у.). Определить процентный состав исходной
смеси.
Решение.
Ag
+ 2HNO3 = AgNO3 + NO2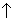 + H2O.
+ H2O.
Газа выделилось
9,856/22,4 = 0,44 моль. Значит, серебра выделилось также 0,44 моль. Пусть было
х г Н2С = О и (3,88-х) т СН3СН = О, или
х/30 моль Н2С = О и (3,88-х)/44 моль СН3СН = О.
Реакции окисления этих альдегидов отличаются друг от друга; промежуточно образующаяся
муравьиная кислота окисляется дальше - до СО2, который с NH3
образует соль:
H2C
= O + 4[Ag(NH3)2]OH = 4Ag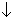 + (NH4)2CO3
+ 6NH3
+ (NH4)2CO3
+ 6NH3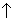 + 2H2O;
+ 2H2O;
CH3CH=O + 2[Ag(NH3)2]OH = 2Ag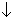 + CH3COONH4
+ 3NH3
+ CH3COONH4
+ 3NH3 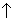 + 2H2O.
+ 2H2O.
Рассчитаем
количество серебра по каждой из реакций и просуммируем:
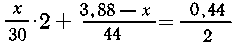
x
= 3,00 г Н2С = О,
тогда СН3СН
= О - 0,88 г. Такм образом, количество муравьиного и уксусного альдегида в смеси
- 0,1 и 0,02 моль соответственно, что составляет 77,3 и 22,7% по массе, или
83,3 и 16,7 мольных %.
Задачи
1.
При сжигании образца каменного угля массой 1 г получилось 0,25 г золы, 0,18
г воды и 2,62 г смеси углекислого и сернистого газов. Сколько процентов серы
содержал образец? Сколько сернистого газа в год выделяется при работе тепловой
электростанции, потребляющей 1 млн т такого угля в год?
2.
При взаимодействии 6,05 г смеси порошков железа и цинка с избытком раствора
хлорида меди(II) образуется 6,4 г металлической меди. Определите состав смеси.
3.
Смесь ацетилена и водорода массой 27 г сожгли в кислороде. После охлаждения
продуктов сгорания до комнатной температуры сконденсировалось 27 мл воды. Определите
состав газовой смеси.
4.
Смесь равных по массе количеств цинка и карбоната кальция обработали избытком
раствора соляной кислоты. Рассчитайте среднюю плотность р образующейся смеси
газов (г/л).
5.
Для полного восстановления 200 мл смеси оксида азота(I) и оксида азота(IV) до
азота было использовано 300 мл водорода. После окончания реакции, конденсации
паров воды и приведения смеси к начальным условиям общий объем составил 225
мл. Определите состав взятой смеси.
6.
К смеси азота, водорода и метана объемом 130 мл добавили 200 мл кислорода, а
затем смесь подожгли. После окончания горения и конденсации паров воды общий
объем полученной смеси газов составил 114 мл при тех же условиях, а после пропускания
продуктов сгорания через избыток раствора щелочи объем уменьшился до 72 мл.
Найдите исходные объемы азота, водорода и метана.
7.
Сплав состоит из рубидия и еще одного щелочного металла. При взаимодействии
4,6 г сплава с водой получено 2,241 л водорода (н. у.). Какой металл является
вторым компонентом сплава? Каковы массовые доли (%) компонентов сплава?
8.
Смесь нитратов натрия и серебра прокалили, а выделившиеся газы пропустили в
воду. При этом объем газов уменьшился в 3 раза. Определите массовый состав исходной
смеси.
9.
Предполагают, что смесь металлических опилок содержит магний, алюминий и олово.
При растворении 0,75 г опилок в соляной кислоте выделилось 0,784 л водорода
(н. у.). При сжигании такой же навески в токе кислорода образовалось 1,31 г
оксидов. Установите процентный состав исходной смеси.
10. Магний
массой 19,2 г сожгли на воздухе. Для растворения полученного вещества понадобилось
320,7 г 20,5%-го раствора НС1. Раствор выпарили и остаток прокалили, конденсируя
летучие вещества. Определите качественный состав конденсата.
11. Через
22,4 л смеси водорода, кислорода и хлора (н. у.) пропустили электрический разряд.
После охлаждения продуктов реакции в сосуде обнаружили газ и жидкость. На нейтрализацию
жидкости пошло 1,6 г гидроксида натрия. Оставшийся в сосуде после реакции газ
полностью прореагировал с нагретым оксидом меди(II), причем масса последнего
уменьшилась на 0,96 г. Определите объемные доли составляющих смесь газов.
12. Смесь
газообразных хлора и хлороводорода объемом 22,4 л пропустили над нагретыми железными
опилками. Масса опилок увеличилась при этом на 42,6 г. Определите состав исходной
смеси.
13. Смесь
хлоридов магния, железа (III) и меди (II) растворили в воде. Масса осадка, образовавшегося
при добавлении избытка сульфида натрия к этому раствору, в 2,51 раза больше,
чем при пропускании избытка сероводорода. Если в растворе заменить хлорид железа
(III) на одинаковое по массе количество хлорида железа (II), отношение масс
осадков станет равно 3,36. Определите состав смеси хлоридов в массовых долях.
Напишите уравнения химических реакций, протекающих в растворах хлоридов при
действии на них сульфидом натрия и сероводородом.
14.
Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком
порошка графита; продукт реакции обработали разбавленной соляной кислотой, при
этом выделилось 11,2 л газа. Определите состав смеси.
15. Смесь
порошков магния и железа массой 6,24 г разделили на две равные части. Одну часть
сожгли в кислороде и получили 4,72 г продуктов сгорания Вторую сожгли на воздухе
и к продуктам сгорания (их масса оказалась равной 4,52 г) прилили раствор гидроксида
натрия. Какой газ и в каком объеме выделился при этом? Приведите уравнения химических
реакций.
16.
Смесь метана и ацетилена объемом 20 мл сожгли в избытке кислорода, при этом
образовалось 32 мл СО2. Определите состав исходной смеси в объемных
долях.
17
К раствору 13,95 г смеси свежеполученных хлорида и бромида хрома(II) прибавили
избыток раствора нитрата серебра. Выпавший осадок имел массу 32,99 г. Определите
количественный состав исходной смеси.
Решения.
1.
Негорючих примесей и водорода в 1 г угля содержится: 0,25 + 0,02 = 0,27 г; серы
и углерода 1-0,27 = 0,73 г. Если углерода х г, то серы (0,73 -х)г.
С + O2
= СО2,
S + O2 = SO2.
Составим уравнение: 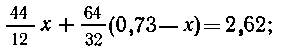 x
= 0,70 г углерода и 0,03 г (3%) серы.
x
= 0,70 г углерода и 0,03 г (3%) серы.
При сжигании
1 млн т угля сгорает 1000000 0,03 = 30000 т серы и образуется
(64/32)
0,03 = 30000 т серы и образуется
(64/32)  30 000 = 60 000 т сернистого газа в год.
30 000 = 60 000 т сернистого газа в год.
|
2. Fe + СuСl2
|
= Сu  + FеСl 2. |
 x x моль |
x моль
|
| ----------------------------------------------------- |
|
Zn + CuCl2
|
= Cu  + ZnCl 2. |
 у у моль |
у моль
|
| ----------------------------------------------------- |
|
Ar(Fе) = 56; Ar(Zn) = 65;
Ar (Сu) = 64.
|
Из уравнений
реакций имеем:
| х моль Fe образует х моль Сu, |
| у моль Zn - " - у моль
Сu. |
Поскольку
масса смеси порошков железа и цинка,. вступивших в реакцию, равна 6,05 г, то
можно записать первое уравнение: 56х + 65y = 6,05
В результате двух реакций образуется (х+у) моль меди, или 64 (х+у)
г. На основании этого запишем второе уравнение: 64 (х+у) = 6,4. Имеем
систему уравнений:
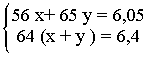
решая которую
получаем x:= 0,05 моль и y = 0,05 моль, или2,8 г Fe и 3,25 г Zn.
3.
2Н2+О2 = 2Н2О;
2С2Н2 + 5О2 = 4СО2 + 2Н2О.
Пусть в смеси
было к моль водорода и у моль ацетилена. Тогда масса исходной
смеси:
2х + 26у = 27 (первое уравнение системы).
По уравнениям реакций: из х моль Н2 получается х моль
Н2О, из у моль С2Н2 - у моль
Н2О. Суммируя, получаем второе уравнение системы: 18 (х+у) =27.
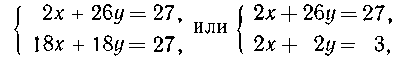
х=0,5
моль Н2, y = 1,0 моль С2Н2.
4.
Пусть цинка было х моль, карбоната кальция - у моль, массы соответственно
равны 65* и ЮОг/. По условию 65#=100г/, г/=0,65х Получается водорода х моль,
или 2х г; СО2 - г/ моль, или 44г/г.
Zn + 2HCl
 ZnCl2+H2
ZnCl2+H2 ;
;
СаСО3 + 2НСl  СаСl2 + СО2
СаСl2 + СО2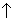 + Н2О.
+ Н2О.
Масса полученной
смеси газов: (2х+44у) г; объем: 22,4 (х+у) л; Средняя плотность:
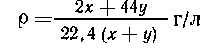
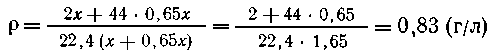
5.
N2O + H2 = N2+H2O;
2N02 + 4H2 = N2 + 4H2O.
Как видно
из уравнений реакций, объем образовавшегося азота не может быть больше начального
объема смеси оксидов азота, если количество водорода соответствует этим уравнениям.
Но по условиям задачи конечный объем (225 мл) больше начального (200 мл), что
указывает на избыток водорода и полное протекание реакции.
Пусть в исходной смеси было х мл оксида азота (I) и у мл оксида
азота (IV). Начальный объем смеси х+у=200 мл. Для выражения конечного
объема смеси запишем следующие уравнения. Конечная смесь состоит из избыточного
водорода и азота. Объем азота равен х+0,5у, что следует из уравнений
реакций. Объем прореагировавшего водорода равен х+2у, а его избыток 300-х-2у,
отсюда конечный объем смеси равен
225 = x + 0,5y + 300- 2y;
y = 50 мл, x = 200-у = 150 мл.
Объем оксида азота (I) 150 мл, объем оксида азота (IV) 50 мл.
6.
2Н2+О = 2Н2О;
СН4 + 2О2 = СО2 + 2Н2О.
Согласно уравнениям реакций в результате горения первоначальный объем смеси
водорода и метана уменьшается. По условию задачи начальный объем смеси равен
130 мл, а общий объем после сгорания - 144 мл. Так как азот не вступает в реакцию
и его объем не меняется, прирост объема достигается за счет избыточного кислорода.
Следовательно, кислород был в избытке и реакции горения прошли до конца.
V(CO2)
= V(CH4) = 144-72 = 72 мл.
Объем смеси после горения:
| 144=130 + 200- |
V(Н2) |
-1/2V (Н2) |
-2 72. 72. |
объем до
горения |
|
обьем О2, соединив-
шегося с Н2 |
объем О2, соединив-
шегося с СН4 |
Отсюда V(Н2)
= 28 мл, V(N2) = 130-72-28 = 30 мл.
7.
2М + 2Н2О = 2МОН + Н2
М - щелочной металл;  (Н2) = 0,l моль;
(Н2) = 0,l моль;  (M) = 0,2 моль; средняя молярная масса:
M = m/v = 4,6/0,2 = 23 г/моль (соответствует атомной массе натрия). Вторым
компонентом сплава может быть только щелочной металл с относительной массой
меньше 23, это - литий; сплав состоит из рубидия и лития
(M) = 0,2 моль; средняя молярная масса:
M = m/v = 4,6/0,2 = 23 г/моль (соответствует атомной массе натрия). Вторым
компонентом сплава может быть только щелочной металл с относительной массой
меньше 23, это - литий; сплав состоит из рубидия и лития
 (Rb)
+
(Rb)
+  (Li) = 0,2 (моль);
(Li) = 0,2 (моль);
m(Rb) + m(Li) = 4,6 (г);
 (Rb)M(Rb)
+
(Rb)M(Rb)
+  (Li)M(Li) = 4,6;
(Li)M(Li) = 4,6;
 (Rb)M(Rb)
+ (0,2-
(Rb)M(Rb)
+ (0,2- (Rb))M(Li) = 4,6;
(Rb))M(Li) = 4,6;
 (Rb)85,5
+ (0,2-
(Rb)85,5
+ (0,2- (Rb)) 7 = 4,6;
(Rb)) 7 = 4,6;
 (Rb) =
0,0408 (моль);
(Rb) =
0,0408 (моль);  (Li)
= 0,1592 (моль).
(Li)
= 0,1592 (моль).
Таким образом, состав смеси:
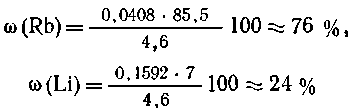
При
пропускании NO2 и О2 в воду оксид азота (IV) поглощается
полностью (так как кислород, согласно уравнениям реакции в избытке):
| 4NO2 |
+ O2 + |
2H2O = 4HNO3. |
 x моль x моль |
x/4 моль |
|
Первоначально
было (х + х/2 + у/2) моль газа, а затем (х + х/4) моль поглотилось
Отсюда (х + х/4) = 2/3(x + х/2 + у/2), или у =
3/4х Итак, в смеси было 170 х г AgNO3 и 85 3/4х = 63,75х г NaNO3,
что составляет 72,72% AgNO3 и 27,28% NaNO3.
3/4х = 63,75х г NaNO3,
что составляет 72,72% AgNO3 и 27,28% NaNO3.
9.
Пусть в смеси х г магния, у г алюминия и z г олова
(или, соответственно x/24, у/27 и z/118,7 моль каждого металла).
| Mg + 2HCl = MgCl2+H2, |
Mg + l/2O2 = MgO; |
| А1 + 3НСl = АlСl3
+ 3/2Н2, |
2Аl + 3/2O2 = А12O3; |
| Sn + 2HCl = SnCl2
+ H2, |
Sn + O2 = SnO2. |
Из
уравнений реакций следует:
| 1 моль магния вытесняет 22,4 л водорода, |
х/24 моль -"- -"- -----
"- - " х/24 22,4/1
л -"-. 22,4/1
л -"-. |
Аналогично
для алюминия и олова, а также для реакций окисления:
| 1 моль магния образует
40 г оксида, , |
х/24 моль - "- - "-
- - - "- -х/24 40/1
г - "- . 40/1
г - "- . |
Запишем
систему уравнений:
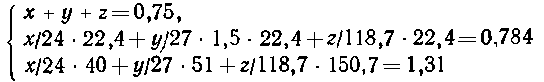
Решая
эту систему, получаем х = 0,48 г магния, у =
0,27 г алюминия, олово в смеси отсутствует z = 0).
10.
Оксид магния растворяется в кислоте:
MgO
+ 2HCl = MgCl2+H2O;
при
этом использовали 320,7-0,205=65,74 г НС1, или 1,80 моль. Для растворения
19,2/24 = 0,8 моль магния требуется 1,60 моль соляной кислоты. Поскольку
кислоты оказалось на 0,20 моль больше, то в продуктах горения должно быть
еще какое-либо соединение, содержащее магний. Таким соединением, по-видимому,
может быть нитрид магния Mg3N2, образующийся наряду
с оксидом при горении магния на воздухе:
2Mg+O2
= 2MgO, 3Mg + N2 = Mg3N2. При растворении
нитрида в кислоте он разлагается:
Mg3N2 + 8HCl = 3MgCl2 + 2NH4Cl.
При прокаливании продуктов будет идти реакция:
2MgCl2 + H2O = (MgCl)2O + 2HCl. В конденсате
присутствуют NH4C1, HC1 и H2O
11. Н2
+ С12 = 2НС1, 2Н2 + О2 = 2Н2О;
HCl + NaOH = NaCl + H2O.
На
нейтрализацию НС1 пошло 1,6 г NaOH, что составляет 0,04 моль. Следовательно,
 (HCl) = 0,04 моль. На образование
НС1 пошло по 0,02 моль Н2 и Сl2. С оксидом
меди прореагировал избыток Н2:
(HCl) = 0,04 моль. На образование
НС1 пошло по 0,02 моль Н2 и Сl2. С оксидом
меди прореагировал избыток Н2:
| СuО + Н2 = |
Сu + Н2О; |
| 1 моль Н2 |
- 16 г О, |
| x моль |
- 0,96 г, |
|
x = 0,06 моль водорода.
|
На
образование воды пошло 1 -(0,06 + 0,02 + 0,02) = 0,9 моль газов, из
них: 0,6 моль Н2 и 0,3 моль О2. Таким образом, состав
смеси (л): С12 - 0,448 (2%); О2 - 6,72 (30%);
Н2 - 15,232 (68%).
12.
Возможные реакции:
Fe
+ 2HCl = FeCl2 + H2; (1)
2Fe + 3Cl2 = 2FeCl3; (2)
2FeCl2 + Cl2 =2FeCl3. (3)(если хлор в большом
избытке)
Обозначим за х моль - количество хлора, а за (1 - -х) моль
- количество НС1 в смеси. Тогда 71х т - масса хлора, а 36,5(1-х)
г - масса хлороводорода. Так как масса железных опилок при прокаливании
в смеси хлора и хлороводорода увеличилась на 42,6 г, то можно записать следующее
соотношение: 7x + 36,5(l-x)-(l-x) = 42,6.
Отсюда х = 0,2 моль хлора (4,48 л), а хлороводорода было 1-х = 0,8
моль (17,92 л). Поскольку в избытке в смеси хлороводород (а не хлор), то
реакция (3) не идет.
13.
При пропускании сероводорода в раствор смеси хлоридов магния (а моль),
железа (III) (b моль) и меди(II) (1- а-b моль):
MgCl2
+ H2S  He идет;
He идет;
2FeCl3 + H2S  2FeCl2 + S
2FeCl2 + S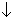 + 2HC1(масса осадка 32b/2 = 16b);
+ 2HC1(масса осадка 32b/2 = 16b);
CuCl2 + H2S  CuS
CuS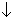 + 2HC1 (масса осадка 96-96а-96b).
+ 2HC1 (масса осадка 96-96а-96b).
Общая масса осадка: (96-96а-80b) г. При добавлении сульфида натрия:
MgCl2
+ Na2S + 2H2O  Mg(OH)2
Mg(OH)2 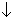 + H2S
+ H2S + 2NaCl (масса
осадка 58а);
+ 2NaCl (масса
осадка 58а);
2FeCl3 + 3Na2S  Fe2S3
Fe2S3 + 6NaCl (масса осадка 104b); (возможно,
FeS + S)
+ 6NaCl (масса осадка 104b); (возможно,
FeS + S)
CuCl2 + Na2S  CuS
CuS + 2NaCl (масса осадка 96-96а-96b).
+ 2NaCl (масса осадка 96-96а-96b).
Общая
массаосадка: (96+8b-38а) г.
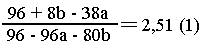
При
добавлении сероводорода к смеси хлоридов магния (а моль), железа(II) (162,5/127)6
= 1,286 и меди(П) (1-а-b) моль:
MgCl2
+ H2S  нe идет;
нe идет;
FеСl2 + Н25  не идет;
не идет;
CuCl2+H2S
 CuS
CuS + 2HCl (масса 96-96а-96b).
+ 2HCl (масса 96-96а-96b).
Общая
масса (96-9ба-96b) г.
При добавлении сульфида натрия: MgCl2 + Na2S + 2H2O Mg(OH)2
Mg(OH)2 + H2S
+ H2S  + 2NaCl (масса осадка 58a);
+ 2NaCl (масса осадка 58a);
FeCl2
+ N2S  FeS + 2NaCl (масса осадка 1,28b
FeS + 2NaCl (масса осадка 1,28b 88);.
88);.
CuCl2 + Na2S  CuS
CuS + 2NaCl (масса осадка 96-96а-96b).
+ 2NaCl (масса осадка 96-96а-96b).
Общая масса осадка: (96-38а + 16,6b) г.
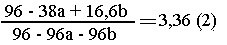
Решаем
систему уравнений (1) и (2):
а = 0,2 моль MgCl2; b = 0,5 моль FеСl3;
с = 0,3 моль СuСl2. Находим состав смеси:
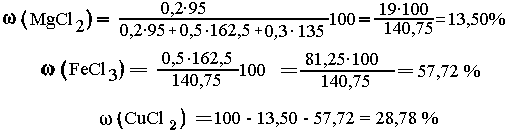
14.
Происходящие реакции:
| Са + 2С = СаС2, |
4А1 + 3С = Аl4С3; |
| СаС2 + 2НС1 = СаСl2+
С2Н2 |
Аl4С3+12НС1
= 4АlС13+ ЗСН4. |
Стехиометрические
схемы:
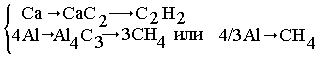
Выделилось
х моль СН4 и (0,5-х) моль С2Н2,
которые образовались из l/3 х моль Аl4С3 и
(0,5-х) моль СаС2; эти количества карбида получены из
4/3 моль А1 и (0,5-х) моль Са. Отсюда:
4/3 27
+ (0,5-x) 40 = 18,8,
27
+ (0,5-x) 40 = 18,8,
36x + 20 - 40x = 18,8,
x = 0,3 моль СН4,
т. е. исходная смесь содержала 0,4 моль А1 (10,8 г) и 0,2 моль Са (8 г).
15.
В кислороде оба металла сгорают однозначно: 2Mg + O2 =2MgO, 3Fe
+ 2O2 = Fe3O4.
Пусть магния было х моль, железа у моль, тогда масса смеси
24x + 56y = 6,24:2 = 3,12;
масса продуктов сгорания 40x + 232/3y = 4,72.
Решая систему уравнений, находим x = 0,06 моль магния; y = 0,03 моль
железа.
В воздухе магний частично реагирует с азотом, образуя нитрид магния: 2Mg
+ O2 = 2MgO, 3Mg + N2 = Mg3N2;
3Fe+2O2=Fe3O4.
Пусть
с азотом прореагировало z моль магния, а с кислородом (0,06-z) моль
магния; тогда массу продуктов сгорания можно выразить следующим образом:
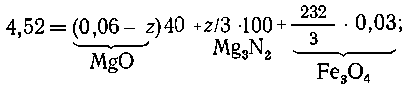
отсюда
z = 0,03 моль
Из
0,03 моль магния образуется 0,01 моль нитрида магния, а из него под действием
щелочного раствора выделяется 0,02 моль аммиака:
| Mg3N2
+ 3Н2О |
= |
3Mg(OH)2, + 2NH3
 . . |
| 0,01 моль |
|
0,02 моль |
Объем
аммиака V = 0,02 моль 22,4 л/моль = 0,448 л (н- у.).
22,4 л/моль = 0,448 л (н- у.).
16. При сгорании происходят процессы:
СН4+2О2 = СO2 + 2Н2О,
С2Н2 + 2,5О2 = 2СО2 + Н2О.
Соотношение объемов СН4: СO2 = 1 : 1, а в случае ацетилена
- С2Н2:СO2 = 1:2, т. е. на каждый 1 моль
ацетилена приходится 1 моль избытка углекислого газа. Объем его превышает
объем исходной смеси на 32-20 = 12 мл, значит, и ацетилена было 12 мл, а
метана - 8 мл, что составляет 60 и 40% соответственно.
17. CrCl2 + 2AgNO3 = Cr(NO3)2
+ 2AgCl ,
,
Cr (NO3 + AgNO3 = Cr (NO3)3
+ Ag ,
,
или в сумме
CrCl2 + 3AgNO3 = Cr(NO3)3 + 2AgCl + Ag
+ Ag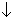 .
.
Аналогично
CrBr2 + 3AgNO3 = Cr(NO3)3 + 2AgBr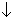 +AgJ.
+AgJ.
Считая реакции протекающими количественно, предположим, что
в смеси было х г СrС12 и (13,95-х) г СrВr2.
| 123 г СrС12 при реакции образуют
395 г осадка AgCl и Ag, |
| х г -"- -"- - - - "-
- - "- - - "- - - "- - - "(395/123) х г -"-
-"-; |
| 212 г СrВr2 при реакции образуют
484 г осадка AgBr и Ag, |
| (13,95-х) г -"- - - "- - -
"- - - - "- - - - "(484/212)x г -"- -"-. |
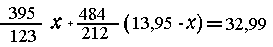
откуда
х=1,23.
Итак,
в смеси было 1,23 г CrCl2 (0,01 моль) и 12,72 CrBr2 (0,06 моль)


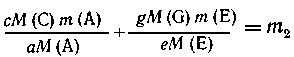
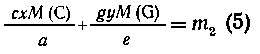
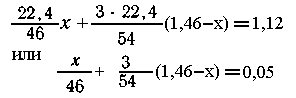
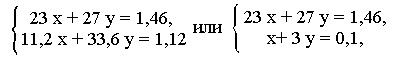
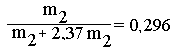 или 29,6 %. Массовая доля цинка 70,4 %.
или 29,6 %. Массовая доля цинка 70,4 %.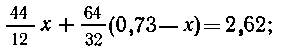 x
= 0,70 г углерода и 0,03 г (3%) серы.
x
= 0,70 г углерода и 0,03 г (3%) серы.