Сорокин В.В.,
Загорский В.В., Свитанько И.В.Задачи химических
олимпиад.
3.2.Сравнение
количественных данных нескольких процессов
"Сообщение такого-то химика о такой-то
реакции не подтвердилось в проверочных
экспериментах". Эта фраза встречается в
научной периодической литературе. Не следует
сразу подозревать в недобросовестности
такого-то химика. Химик такой-то воспроизводит
свои результаты несчетное количество раз и
удивляется, почему у других это не выходит. Все
происходит потому, что химический эксперимент
имеет множество нюансов, которые автоматически
повторяет его автор и о которых не догадываются
остальные. Малейшее изменение в условиях - и
реакция идет по другому пути, особенно в
органической химии.
В предлагаемых в этом параграфе задачах
сравниваются качественные и количественные
результаты на первый взгляд одинаковых реакций,
которые вовсе не одинаковы...
Сравнивать результаты нескольких реакций
приходится и тогда, когда к одному продукту
приходят разными путями, и расчет по каждому в
отдельности дает данные необходимые, но не
достаточные; учитывая все вместе, можно решить
задачу.
Пример 1. В две пробирки положили по
одинаковому кусочку цинка, а затем прилили
некоторое количество 30%-и азотной кислоты и такое
же количество воды. В первую пробирку сначала
налили воду, а затем медленно приливали кислоту,
во вторую- сначала налили кислоту, а затем
медленно приливали воду. Какие вещества
образовались? Как доказать различие содержимого
пробирок после окончания реакций?
Решение. В первой пробирке сначала
образуется разбавленная азотная кислота,
реагирующая с цинком с образованием нитрата
аммония:
4Zn + mHNO3 = 4Zn(NO3)2 + NH4NO3
+ 3H2O,
и по мере добавления кислоты ее концентрация
растет, что приводит к протеканию других реакций
и образованию других продуктов (например, азота и
оксида азота(II)).
Во второй пробирке сначала присутствует
довольно концентрированная азотная кислота,
реагирующая с цинком с выделением оксида азота
(II):
3Zn + 8HNO3 = 3Zn(NO3)2+2NO + 4H2O,
+ 4H2O,
и по мере добавления воды ее концентрация
падает, но не настолько, чтобы шло образование
ионов аммония.
Таким образом, ионы аммония присутствуют
только в первой пробирке и могут быть обнаружены
по выделению аммиака при действии щелочи:
NH4NO3 + NaOH = NaNO3 + H2O
+ NH3 ,
,
Zn(NO3)2 + 2NaOH = Zn(OH)2 + NaNO3.
+ NaNO3.
Пример 2. Два юных химика определяли
концентрацию раствора азотной кислоты. Один из
них отмерил 10,0 мл кислоты и добавил его к избытку
металлической меди. При этом он получил 746 мл
газа, превратившегося при сильном охлаждении в
сине-зеленую жидкость. Второй предварительно
разбавил 10,0 мл кислоты водой в 10 раз и обработал
полученным раствором порошок свинца. При этом он
получил 560 мл газа (объемы газов приведены к н. у.,
выходы количественные). Определить концентрацию
азотной кислоты и объяснить различия в
результатах опыта.
Решение. Сине-зеленая жидкость, образующаяся
при охлаждении газа, представляет собой NОз;
таким образом, газ, выделившийся в реакции с
медью, - эквимолярная смесь NO и NO2:
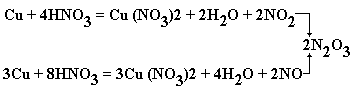
746 мл газа составляют 0,033 моль, или по 0,0167 моль NO
и NO2. В реакцию вступило-0,0167 6 = 0,1 моль HNO3.
Следовательно, 10 мл раствора HNOs содержат 0,1 моль
кислоты, 1 л содержит соответственно 10 моль.
6 = 0,1 моль HNO3.
Следовательно, 10 мл раствора HNOs содержат 0,1 моль
кислоты, 1 л содержит соответственно 10 моль.
Во втором опыте используют заведомо
разбавленную HNOs и малоактивный металл, и реакция
приводит к образованию только оксида азота(II):
3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO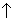 + 4H2O.
+ 4H2O.
560 мл газа составляют 0,025 моль;
| 8 моль |
HNO3 |
дают 2 моль NO, |
| х моль |
|
0,025 моль NO, |
|
х - 0,1 моль. |
|
10,0 мл исходного раствора HNO3 содержат 0,1
моль кислоты, что соответствует результатам
первого эксперимента.Различие в объемах
полученных газов, таким образом, объясняется
различием в условиях проведения реакций.
Задачи
1. Выходящий из доменной печи газ имеет
следующий состав (объемные доли 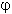 в %):
в %): 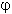 (СО)2 - 12,0;
(СО)2 - 12,0; 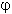 (СО) - 28,0;
(СО) - 28,0; 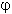 (Н2) - 3,0;
(Н2) - 3,0; 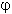 (СН4) - 0,6;
(СН4) - 0,6; 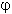 (С2Н4)-0,2;
(С2Н4)-0,2;
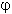 (N2)
-56,2.
(N2)
-56,2.
Рассчитайте, сколько потребуется воздуха (в м3)
для полного сжигания 200 м3 этого газа
(объемы измерены при одной температуре). Считать,
что содержание кислорода в воздухе около 20% по
объему. Определите количественный состав
продуктов сжигания доменного газа в 20%-м избытке
воздуха.
2. Какой объем 8%-го раствора гидроксида
натрия (плотность = 1,09 г/см3) потребуется для
полной нейтрализации 100 мл раствора серной
кислоты, если известно, что из 10 мл данного
раствора серной кислоты при добавлении избытка
хлорида бария можно получить 0,233 г осадка.
3. При нагревании 98 г бертолетовой соли
(КСЮз) часть ее разложилась с выделением
кислорода, а часть - с образованием хлорида калия
и перхлората калия (КС1О4). Определите
состав твердого остатка, если выделилось 19,2 г
кислорода.
4. Соль одновалентного металла массой
74,4 г нагрели в закрытом сосуде, при этом
получилось 26,8 мл бесцветной жидкости с
концентрацией вещества 11,2 моль/л. Определите
формулу соли, если известно, что она содержит
металл, водород, 25,8% серы и 51,61% кислорода.
5. При образовании 1 моль воды из
простых веществ выделяется 284 кДж теплоты; при
образовании 1 моль оксида углерода (IV) - 395 кДж.
Сгорая, 1 моль метана выделяет 893 кДж, а 1 моль
ацетилена 1310 кДж. Рассчитайте, сколько теплоты
выделится при образовании 1 моль ацетилена при
термическом разложении метана, учитывая, что
тепловой эффект реакции образования простых
веществ равен нулю.
6. Ток последовательно проходит через
ряд электролизеров с водными растворами: а) CuSO4;
б) NiSO4; в) Fe2(SO4)3 г)FeСl2.
Какие массы металлов выделились на катодах, если
известно, что у анода последнего электролизера
выделилось 1,4 л хлора (н. у.). (Анодные и катодные
пространства, а также сами электролизеры
разделены диафрагмами.)
Решения
1. По первому вопросу задачи -
приходится объемных частей О2 на объемные
доли газов (из условия):
| 2СО + О2 = 2СО2 |
-14,0, |
| 2Н2 + O2 = 2Н2О |
- 1,5, |
| СН4 + 2О2 = СО2
+ 2Н20 |
- 1,2, |
| С2Н4 + 3О2 =
2СО2 + 2Н2О |
- 0,6. |
Всего 17,3/0,2 = 86,5 частей воздуха на 100 частей газа;
200 м3 газа соответствуют 2-86,5 = 173 м3+ +20%
(34,6 м3) воздуха; всего 207,6 м3 воздуха. По
второму вопросу задачи - 207,6-0,2 = 41,52 м3 О2
на 200 м3 газа; тогда получится 20,76 м3 О2
или 103,8 м3 воздуха и соответственно 83,04 м3
азота на 100 м3 доменного газа.
Баланс по уравнениям реакций:
| CO2 |
H2O |
N2 |
O2 |
| 12,00 |
3,00 |
56,20 |
20,76 |
| + |
+ |
+ |
- |
| 28,00 |
1,20 |
83,04 |
17,30 |
| + |
+ |
-------- |
-------- |
| 0,60 |
0,40 |
139,24 |
3,46 |
+ |
-------- |
|
|
| 0,40 |
4,60 |
|
|
| ---------- |
|
|
|
| 41,00 |
|
|
|
Всего: 41,00+4,60+139,24+3,46=188,30 объемных частей
газа.
2. Уравнение реакции образования
осадка сульфата бария:
|
|
0,233 г |
| H2SO4 |
+ВаСl2 = |
BaSO4 +2HCl, +2HCl, |
| М |
избыток |
233 г/моль |
| v 0,001 моль |
|
0,001 моль |
так как 0,233 г BaSO4 составляет 0,001 моль
вещества. Нейтрализация серной кислоты
гидроксидом натрия:
| H2SO4 + |
2NaOH = |
Na2SO4 + 2Н2О |
| М |
40 г/моль |
|
| В 10 мл серной кислоты - 0,001 моль
H2SO4, |
| в 100 мл -" - - "- - -"----"
---" х моль H2SO4, |
X = 0,01 моль H2SO4, |
Таким образом, на нейтрализацию 0,01 моль H2SO4
требуется согласно уравнению реакции
нейтрализации 0,02 моль NaOH, что составляет 40 0,02 = 0,8 (г).
Масса раствора гидроксида натрия (
0,02 = 0,8 (г).
Масса раствора гидроксида натрия ( = 8%), пошедшего на нейтрализацию,
равна 0,8
= 8%), пошедшего на нейтрализацию,
равна 0,8 100/8=10
(г) раствора, а объем раствора составляет 10/1,09 = 9,17
мл NaOH.
100/8=10
(г) раствора, а объем раствора составляет 10/1,09 = 9,17
мл NaOH.
3. Составляем уравнения реакций,
происходящих при нагревании бертолетовой соли:
| 2КСlO3 = 2КСl + 3O2;
(1)(при нагревании) |
| 4КСlO3 = КСl + 3КСlO4. (2)
(при нагревании) |
| М(КСlО3) = 122,5 г/моль;
М(КСl) = 74,5 г/моль; |
| М(О2) = 32 г/моль; М(КСlО4)
= 138,5 г/моль. |
Находим массу КСlO3, разложившегося по
уравнению (1):
2 122,5 г КСlO3 - 3 122,5 г КСlO3 - 3 32 г О2 32 г О2 |
| х г - "- - - - - "- -
-"19,2 О2, |
х = 49 г КС1О3. |
При этом образовалось КС1:
2 74,5 г КС1 - 3 74,5 г КС1 - 3 32 г О2, 32 г О2, |
| у г - "- - --- - - -"19,2 г О2, |
y = 29,8 г КС1. |
По уравнению (2) разложилось 98-49 = 49г КСlO3.
Находим массу образовавшегося КСl:
4 122,5 г КСlO3 - 74,5 г КСl, 122,5 г КСlO3 - 74,5 г КСl, |
| 49 г - "- - - -"- - - " х
г КСl, |
х = 7,45 г КС1. |
Масса образовавшегося КС1О4:
4 122,5 г КСlO3 --- 3 122,5 г КСlO3 --- 3 138,5 г КС1О4, 138,5 г КС1О4, |
| 49 г - "- - - -" - - - -
" у г КС1О4, |
| y = 41,55 г КС1О4. |
Состав твердого остатка: 29,8+7,45=37,25 г КС1, 41,55 г
КС1О4.
4. В растворе содержалось 0,0268 • 11,2 = 0,3
моль соли с относительной молекулярной массой
74.4/0,3 = 248
Один моль соли содержит 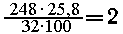 моль атомов S и
моль атомов S и 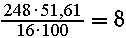 моль атомов O2
моль атомов O2
На металл и водород от величины 248
приходится 56. Из одновалентных металлов, соли
которых устойчивы в водных растворах, подходят Li,
Na, К (другие отпадают, так как тогда получающиеся
брутто-формулы не соответствуют реальным
соединениям). Если металл Na, тогда соль - Na2S2O3 5H2O -
тиосульфат натрия.
5H2O -
тиосульфат натрия.
| 5. Н2+1/2О2 = П2О
+ 284кДж; |
| С + О2 = СО2 + 395 кДж; |
| СН4 + 2О2 = СО2 + 2Н2О
+ 893 кДж; |
| С2Н2 + 5/2O2 = 2СO2
+ Н2О + 1310 кДж; |
2CH4  С2Н2 + 3H2 + Q.
С2Н2 + 3H2 + Q. |
Для определения неизвестной теплоты реакции
надо провести алгебраическое сложение
термохимических уравнений образования входящих
в нее сложных веществ:
Q = 2Q (CH4) -Q (C2H2) -3Q (Н2) = 2 893-1310-3
893-1310-3 284 = -376 кДж.
284 = -376 кДж.
Реакция идет с поглощением тепла.
6. FеС12  Fe + Cl2
Fe + Cl2  (анод-побочное образование
Fe3+). 1,4л хлора составляют 0,0625 моль вещества.
Таким образом, на катоде выделилось 0,0625 г/моль
железа, или 3,5 г.
(анод-побочное образование
Fe3+). 1,4л хлора составляют 0,0625 моль вещества.
Таким образом, на катоде выделилось 0,0625 г/моль
железа, или 3,5 г.
Количество электричества, прошедшее через все
электролизеры, одинаково. Согласно закону
Фарадея в этом случае выделилось одинаковое
количество эквивалентов всех металлов (1
г-эквивалент соответствует молярной массе на
единицу степени окисления), причем в последнем
электролизере (с водным раствором FеС12) Э(Fе)
=56/2 = 28, т. е. 3,5 г составляют 0,125 г-экв. Тогда
| Fe2(SO4)3 :
Э(Fe) = 56/3 = 18,67 |
m(Fe) = 0,125 18,67 = 2,33(г). 18,67 = 2,33(г). |
| NiSO4 : Э(Ni) = 58,7/2 = 29, 35 |
m(Ni) = 0,125 29,35
= 3, 67(г). 29,35
= 3, 67(г). |
| CuSO4 : Э(Cu) = 64/2 = 32 |
m(Cu) = 0,125 32
= 4(г) 32
= 4(г) |


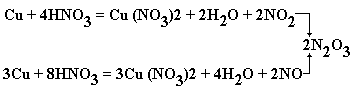
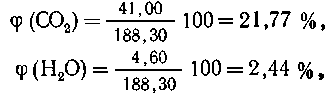
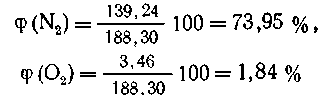
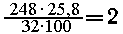 моль атомов S и
моль атомов S и 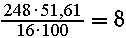 моль атомов O2
моль атомов O2