


Основы биохимии. Физическая химия
Вода как растворитель
 Как известно, жизнь зародилась в воде и
по-прежнему остается тесно связанной с водой. Поэтому физико-химические свойства
воды имеют фундаментальное значение для процесоов
жизнедеятельности.
Как известно, жизнь зародилась в воде и
по-прежнему остается тесно связанной с водой. Поэтому физико-химические свойства
воды имеют фундаментальное значение для процесоов
жизнедеятельности.
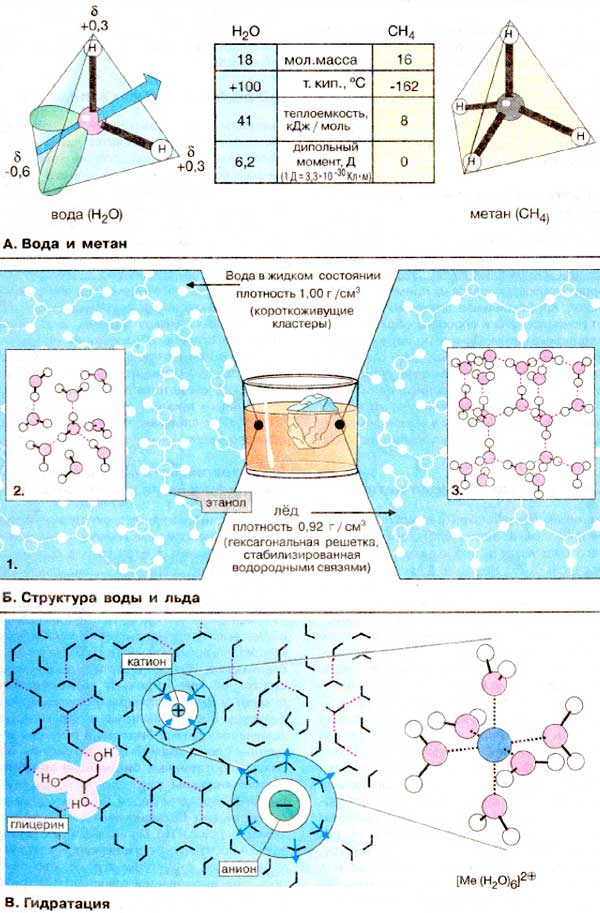
А. Вода и метан
Уникальные свойства воды H2O
становятся очевидными при сравнении с метаном
(CH4). Обе молекулы одинаковы по массе и размерам. Тем не менее
температура кипения воды на 250оС выше по сравнению с температурой
кипения метана. В результате вода на поверхности Земли находится в жидком, а
метан — в газообразном состоянии. Высокая точка кипения воды является следствием
высокой теплоемкости испарения, что в свою очередь обусловлено неравномерным
распределением электронной плотности в молекуле воды. Молекула воды имеет форму
тетраэдра, в центре которого расположен атом кислорода. Две вершины тетраэдра
заняты свободными электронными парами атома кислорода (зеленого цвета), а
остальные две — атомами водорода. Поэтому связи H—О—H расположены под углом друг
к другу. Кроме того, из-за высокой электроотрицательности атома кислорода связь
О—H полярна (см. с. 14). Атомы водорода несут частичный положительный заряд
около +0,4, а атом кислорода — частичный отрицательный заряд около -0,6, т. е,
молекула воды представляет собой электрический диполь. Поэтому каждая
молекула воды, подобно маленькому магниту, притягивает к себе за счет
образования водородных мостиков (Б) еще четыре молекулы
(см. с. 14). При
испарении воды разрушение зтих многочисленных водородных связей требует больших
затрат энергии. Молекулы метана неполярны, не являются диполями и относительно
слабо взаимодействуют друг с другом. Вследствие этого жидкий метан испаряется
при очень низких температурах.
Б. Структура воды и
льда
Биполярное строение молекул воды
благоприятствует образованию водородных связей (см. с. 14). При этом каждая
молекула проявляет свойства как донора, так и акцептора водорода. Поэтому у воды в жидком
состоянии многие молекулы связаны между собой водородными «мостиками» (связями)
(1). причем образующиеся ассоциаты находятся в динамическом равновесии. Часто
образуются тетраэдрические структуры, так называемые "кластеры" воды (2). При
понижении температуры доля кластеров возрастает вплоть до начала кристаллизации.
При нормальном атмосферном давлении вода кристаллизуется при 0oC. при
этом большинство молекул воды оказываются встроенными в гексагональную решетку
(3). Поскольку в твердом состоянии расстояние между молекулами в среднем больше,
чем в жидкости, плотность льда меньше по сравнению с плотностью воды. Это
свойство воды очень важно в экологическом отношении хотя бы потому, что зимой на
поверхности водоемов образуется слой льда и они редко промерзают до
дна.
В. Гидратация
В отличие от большинства других жидкостей
вода является идеальным растворителем для диссоциирующих веществ. В
электрическом поле того или иного иона молекулы воды образуют регулярные структуры
в соответствии с зарядом иона. Эта гидратная оболочка экранирует ион от ионов
противоположного заряда. Вода имеет высокую константу диэлектрической
проницаемости (78), т.е. в воде электростатическое притяжение двух
противоположно заряженных ионов снижается примерно в 80 раз (1/78). Молекулы
воды, находящиеся во внутренней сфере непосредственно около иона, практически
иммобилизованы (привязаны к этому иону) и перемещаются вместе с центральным
ионом. Хорошо растворимы в воде и нейтральные соединения с несколькими
гидроксильными группами, такие, как глицерин (на схеме слева) или сахара,
поскольку они способны образовывать водородные связи с молекулами
растворителя.