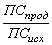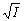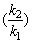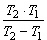|
ПРЕПОДАВАТЕЛЯМ И СТУДЕНТАМ
К экзамену допускаются только студенты,
выполнившие и сдавшие все лабораторные работы и
успешно сдавшие все три коллоквиума!
В практикантской книжке должна быть проставлена
оценка за семестр.
Подписанная книжка сдается преподавателю.
Практикантская книжка будет на экзамене.
В зачетной книжке и экзаменационной ведомости
преподавателем проставляется "зачет" по
курсу общей химии.
Не сдавая экзамен, получить “отлично” могут
студенты, сдавшие все коллоквиумы на «отлично»
(без пересдач) и, кроме того, написавшие реферат
по одной из выбранных теме.
Посещение всех лекций обязательно!!!
ПЛАН ЛЕКЦИЙ
1. Химия и география - связи между двумя науками.
Законы химического взаимодействия. Соединения
переменного состава.
2. Первый закон термодинамики. Работа реакции.
Внутренняя энергия и энтальпия. Закон Гесса.
3. Скорость реакции. Зависимость скорости от
концентрации. Порядок и молекулярность.
4. Зависимость скорости реакции от температуры.
Энергия активации. Катализ.
5. Химическое равновесие. Смещение равновесия.
Константа равновесия. Изобарный потенциал
реакции. Принцип Ле Шателье.
6. Правило фаз. Диаграмма состояния воды. Растворы
неэлектролитов.
7. Растворы электролитов. Водородный показатель.
рН растворов. Гидролиз. Буферные растворы.
Амфотерность.
8. Окислительно-восстановительные реакции.
Подбор коэффициентов в уравнениях ОВР.
9. Равновесие металл-раствор. Двойной
электрический слой. Концентрационные цепи.
Направление и скорость коррозии. Электролиз.
10.Растворимость и ПР. Равновесия в растворах
комплексных солей. Образование и растворение
осадков.
11.Строение вещества. Ядро атома. Распределение
электронов по энергетическим уровням и
подуровням. Валентность.
12.Метод ВС. Угол между связями. Гибридизация. Виды
химической связи.
13.Строение и названия комплексных соединений.
Магнитные свойства комплексных соединений
(солей).
14. Водородная связь. Металлическая связь.
Проводники, полупроводники и диэлектрики.
15. Дисперсные системы. Коллоидная частица и ее
строение. Золь. Коагуляция. Пептизация.
Седиментация.
16. Обзор по химии элементов.
17. Обзор по химии элементов (продолжение).
18. Природные химические процессы. Охрана
окружающей среды.
ЛИТЕРАТУРА
1.Зайцев О.С. Исследовательский практикум по
общей химии. М.: Изд-во МГУ, 1994, 480 с.
2. Зайцев О.С. Химия. Современный краткий курс. М.:
Агар, 1997, 416 с.
3. Зайцев О.С. Задачи, упражнения и вопросы по
химии. М.:Химия, 1996, 432 с.
4. Практикум по общей химии: Учеб. пособие/Под ред.
С.Ф.Дунаева – М.: Изд-во МГУ, 2005.– 336 с. –
(«Классический университетский учебник»)
5. Общая химия. Под ред. Соколовской Е.М., Изд-во
Московского Университета, 1980, 726 с.
6. Витинг Л.М., Резницкий Л.А. Задачи и упражнения
по общей химии / М.: Изд-во МГУ, 1995, 221 с.
7. Глинка Н.Л. Общая химия (любое издание).
8. Хомченко Г.П. Пособие по химии для поступающих в
вуз (любое издание).
КАЛЕНДАРНЫЙ УЧЕБНЫЙ ПЛАН
Лабораторных и семинарских занятий по общей
химии для студентов I курса географического
факультета на 2006-2007 учебный год
Учебная литература:
Учебник:
О.С.Зайцев Химия. Современный краткий курс / М.:
Агар, 1997, 416 с.
Пособия для практикума:
[1] Практикум по общей химии: Учеб. пособие / Под
ред. С.Ф.Дунаева. – М.: Изд-во МГУ,
2005.– 336 с. – («Классический университетский
учебник»)
[2] О.С.Зайцев Исследовательский практикум по
общей химии / М.: Изд-во МГУ, 1994, 480 с.
Задачник:
[3] О.С.Зайцев Задачи, упражнения и вопросы по
химии / М.: Химия. 1996, 432 с.
Дополнительная литература:
- Общая химия. Под ред. Е.М.Соколовской, Л.С.Гузея /
М.: Изд-во МГУ, 1989, 726 с.
- Витинг Л.М., Резницкий Л.А. Задачи и упражнения по
общей химии / М.: Изд-во МГУ, 1995, 221 с.
Дата |
Тема семинара |
Лабораторная
работа |
Задачи |
6,7 сентября |
Правила работы в
практикуме. Техника безопасности. Порядок
подготовки и выполнения работ по химии. Основные
законы химического взаимодействия |
Определение атомной массы
металла
[1] – с. 7-8, 24-28, работа 1, опыт 1
[2] – с. 107-113, опыт 6-2; 6-3 |
[3] 1-83; 1-94 |
13,14 сентября |
Тепловые эффекты
химических реакций. Энтальпия реакции. Закон
Гесса. |
Тепловые эффекты химических
реакций
[1] – с. 77-81, 84-87, работа 2, опыт 3
[2] – с. 129, опыты 7-9 – 7-11 |
[3] 13-14; 13-15 |
20,21 сентября |
Скорость химических
реакций. Зависимость скорости реакции от
концентрации реагирующих веществ и температуры.
Энергия активации. |
Исследование зависимости
скорости реакции от концентрации реагирующих
веществ и температуры
[1] – с. 88-91, 95-98, работа 2, опыты
2,3
[2] – с. 137, опыты 8-8 – 8-16, с. 139,
опыты 8-17 – 8-23 |
[3] 17-40 (1,2,4); 17-62;
18-46 |
27,28 сентября |
Химическое равновесие.
Константа равновесия. Катализ. |
Изучение кинетики разложения
пероксида водорода на гетерогенном катализаторе
[1] – с. 88-95, работа 1, опыт 1
[2] – с. 142, опыты 9-7; 9-10 – 9-14 |
[3] 17-17; 17-80 |
4,5 октября |
КОЛЛОКВИУМ 1 |
Отработки |
|
11,12 октября |
Растворы. Способы
выражения концентрации растворов. Коллигативные
свойства растворов. |
Приготовление растворов
заданной концентрации. Титрование.
[1] – с.33-37, работа 1, опыты 1,2;
с. 38-41, работа 2, опыты 6,7
[2] – c. 95-97, опыт 4-13 (2);
с. 177-178, опыты 13-6 – 13-8 |
[3] 22-2; 22-3 |
18,19 октября |
Растворы электролитов.
Равновесия в растворах кислот и оснований. рН
растворов кислот и оснований.
Буферные растворы. |
Исследование равновесий в
растворах кислот и оснований.
[1] – с. 52-54, 57-67, работа 1, опыты
1,2; работа 2,опыты 4-9;
работа 3, опыты 10, 11.
[2] – с. 165, опыты 11-6;11-7; 11-10
– 11-18, 11-30; с. 199, опыт 15-5 |
[3] 23-47; 23-96; 23-97 |
25,26 октября |
Амфотерные электролиты.
Равновесия в растворах малорастворимых
электролитов.
Равновесия в растворах гидролизующихся солей. |
Исследование равновесий в
растворах малорастворимых электролитов
[1] – с. 56, 70-73, работа 5, опыты
20-22; c. 66, опыт 10; с. 235
опыт 6.1
[2] – с. 203, опыт 16-5; с. 249,
опыт 20-7.
Исследование равновесий в растворах
гидролизующихся солей.
[1] – с. 55-56, 67-70, работа 4,
опыты 15-19
[2 ] – с. 188, опыты 14-6; 14-53 |
[3] 24-7 (1,2); 24-46 (1);
28-57. |
1,2 ноября |
КОЛЛОКВИУМ 2 |
Отработки |
|
8,9 ноября |
КОЛЛОКВИУМ 2 |
Отработки |
|
15,16 ноября |
Окислительно-восстановительные
реакции |
Изучение
окислительно-восстановительных свойств
элементов V, VI, VII групп
[1] – с. 106-114, работа 1, опыты
3,4; работа 2, опыты 5,7
[2] – с. 265, опыты 21-7; 21-9; 22-35;
22-59; 22-61; 22-78 |
[3] 26-2; 26-7(1,2); 26-8 (1);
26-11(5) |
22,23 ноября |
Электрохимические
процессы. Окислительно-восстановительные
потенциалы. ЭДС процесса. |
Изучение
окислительно-восстановительных свойств
металлов
[1] – с.115-120, работа 1, опыты 1,2
[2] – c. 330-331, опыты 26-7, 26-9;
с. 364, опыт 27-13; с. 371, опыт
27-25; с. 374, опыт 27-33,
с. 380, опыт 27-38 |
[3] 26-31 (9); 27-25 (4);
27-25 (1-1); 27-25 (2);
27-25 (3-1). |
29,30 ноября |
Комплексные соединения
и двойные соли |
Изучение равновесий в растворах
комплексных соединений
[1] – с. 127-133, работа 2, опыты
4–6
[2] – с. 389, опыты 28-1; c. 394
(Fe2+); c. 395 (Fe3+);
c. 401, опыт 28-11 (б, в, г, д, е,
ж, к, р) |
[3] 25-50; 25-61 |
6,7 декабря |
Строение атома.
Периодический закон. Химическая связь. |
Коллоидные растворы
[1] – с. 137-142, работа 1, опыты
1,3,4; работа 2, опыт 5
[2] – с. 425, опыты 29- 2,3,4,7,8,14,
18;
Свойства переходных металлов на примере Fe и Cr
[1] – с. 230-235, работа 1, опыты 5-7;
с. 246-252, работа 1, опыты
1,5,8,10
[2] – с. 203, оп. 16-5; с. 290, оп. 23-4
(1,2,3,4,6) |
[3] 9-17 (1) |
13,14 декабря |
КОЛЛОКВИУМ 3 |
Отработки |
|
20,21 декабря |
ЗАЧЕТ |
Отработки |
|
27,28 декабря |
ЗАЧЕТ |
Отработки |
|
ВОПРОСЫ ПЕРВОГО КОЛЛОКВИУМА
Атомная масса элемента и методы
ее определения. Эквивалент. Мольная масса
эквивалента. Закон и число Фарадея. Мольная масса
соединения. Эквивалент кислоты и основания.
Основные законы химического взаимодействия.
Стехиометрия. Нестехиометрические соединения.
Соединения переменного состава. Закон
постоянства состава. Валентность.
Уравнение газового состояния и
универсальная газовая постоянная. Постоянная
Больцмана. Внутренняя энергия системы. Тепловой
эффект химической реакции. Изменение энтальпии в
химической реакции. Первый закон термодинамики.
Закон Гесса и его следствия. Энтальпия
образования соединения. Две движущие силы
химического процесса. Представление об энтропии.
Предсказание знака изменения энтропии в
химической реакции. Изобарный и изохорный
потенциалы реакции (энергия Гиббса и
Гельмгольца).
Скорость химической реакции. Средняя и
истинная скорости. Закон действующих масс.
Кинетическое уравнение реакции. Порядок и
молекулярность. Общие представления о реакциях
нулевого и первого порядков. Кинетика
радиоактивного распада. Период полураспада.
Скорость последовательных и параллельных
реакций.
Зависимость скорости от температуры.
Правило Вант-Гоффа. Уравнение Аррениуса. Энергия
активации. Распределение молекул по энергиям
Максвелла-Больцмана. Катализ.
Константа равновесия гетерогенного
процесса. Принцип Ле Шателье. Энтропия активации.
Основное уравнение химической кинетики.
Скорость гетерогенного процесса. Связь
константы равновесия с изобарным потенциалом.
Правило фаз Гиббса. Диаграмма состояния воды.
Процессы плавления, испарения и возгонки. Кривые
охлаждения (нагревания). Термический анализ.
Аномальные свойства воды.
ВОПРОСЫ ВТОРОГО КОЛЛОКВИУМА
Растворы. Способы приготовления
растворов. Способы выражения концентрации
растворов. Титрование.
Общие свойства растворов. Законы Рауля и
Вант-Гоффа. Изучение растворов методами
эбуллиоскопии, криоскопии и осмотического
давления (расчет мольной массы неэлектролита и
степени диссоциации электролита).
Растворы электролитов и неэлектролитов.
Сильные и слабые электролиты. Степень
диссоциации.
Теория сильных электролитов. Ионная сила
раствора. Активность. Коэффициент активности.
Ионное произведение воды. Водородный
показатель. Среда растворов сильных и слабых
кислот и оснований. Расчет рН в растворах
сильных и слабых кислот и оснований.
Гидролиз солей. Среда растворов солей.
Расчет рН в растворах гидролизующихся солей.
Буферные растворы. Объяснение механизма
буферного действия. Буферная емкость растворов.
Расчет рН буферных растворов. Буферные растворы
в природе.
Амфотерные электролиты. Переход
бихромат-хромат (ионы). Среда растворов фосфатов.
Растворимость. Способы выражения
растворимости. Произведение растворимости.
Условие образования и растворения осадков.
Влияние одноименного иона и ионной силы на
растворимость.
ВОПРОСЫ ТРЕТЬЕГО КОЛЛОКВИУМА
Электродные потенциалы. Двойной
электрический слой. Стандартный водородный
электрод. Стандартные потенциалы и ЭДС. Формула
Нернста. Расчет потенциала и ЭДС при
нестандартных условиях.
Работа окислительно-восстановительной
реакции. Константа равновесия. Условия
протекания окислительно-восстановительной
реакции. Окислительно-восстановительные
реакции: важнейшие окислители и восстановители,
классификация реакций, подбор коэффициентов в
уравнениях, мольная масса эквивалента
окислителя и восстановителя. Окисление
перманганатом калия в различных средах. Пероксид
водорода как окислитель и восстановитель.
Концентрационные цепи и их использование для
определения рН, ПР, константы нестойкости
комплексного соединения.
Комплексные соединения. Лиганды.
Координационные числа. Равновесия в растворах
комплексных солей. Константа нестойкости
комплексного иона. Расчет концентраций ионов в
растворах комплексных солей.
Дисперсные системы. Коллоидное состояние
вещества. Гранула. Строение мицеллы. Коагуляция.
Седиментация. Пептизация. Лиофильные и лиофобные
коллоиды. Золи. Гели.
Материя. Поле и вещество. Состав ядра
атома. Изотопы, нуклиды. Тяжелая вода.
Распространенность атомных ядер в земной коре.
Периодический закон Д.И.Менделеева.
Периодическая система элементов. Группы,
подгруппы и периоды. Предсказательная функция
периодической системы.
Основные положения теории электронного
строения атома. Квантовый характер
энергетических изменений.
Корпускулярно-волновой дуализм. Принцип
неопределенности. Квантовые числа. Электронные
орбитали. Принцип Паули. Правило Гунда.
Заполнение электронами энергетических уровней и
подуровней.
Химическая связь как перекрывание
атомных орбиталей и образование молекулярных
орбиталей. Условия образования молекул. Типы
химической связи: неполярная, полярная и ионная.
Механизмы образования связи: ковалентный и
донорно-акцепторный. Гибридизация атомных
орбиталей. Углы между связями. Одинарная, двойная
и тройная связи. Молекулы кислорода, азота, воды,
аммиака, метана, этана, этилена, ацетилена. Ионы
аммония и гидроксония. Структуры алмаза и
графита. Водородная связь.
Обзор химических свойств элементов и их
соединений:
s-элементы I группы: место водорода в
периодической системе; сходство и отличие
водорода от щелочных металлов и галогенов;
щелочные металлы.
р-элементы III группы: сравнение свойств бора,
алюминия и галлия; амфотерность соединений
алюминия; гидролиз солей алюминия.
р-элементы IV группы: особое положение углерода в
периодической системе и его способность
образовывать органические соединения; угольная
и кремниевая кислоты и их соли.
р-элементы V группы: отличие и сходства азота и
фосфора и их соединений; кислородные кислоты
азота и их соли; аммиак и фосфин; азотные и
фосфорные удобрения.
р-элементы VI группы: кислород и озон –
аллотропные модификации кислорода; окисление
озоном; классификация оксидов; пероксид водорода
и его окислительно-восстановительные свойства.
Сера и ее валентные состояния; соединения серы с
кислородом и водородом; кислородные кислоты
серы; сравнение свойств серной и сернистой
кислот; сульфаты и сульфиты.
р-элементы VII группы: общая характеристика
галогенов; галогеноводороды; свойства водных
растворов галогеноводородов; кислородные
кислоты хлора.
d-элементы IV периода: общая характеристика
элементов и их оксидов; изменение характера
оксидов в зависимости от степени окисления
элемента; изменение свойств элементов и их
соединений в зависимости от строения атома.
ПРЕПОДАВАТЕЛЮ, ПРИНИМАЮЩЕМУ ЭКЗАМЕНЫ НА
ГЕОГРАФИЧЕСКОМ ФАКУЛЬТЕТЕ
1.Студенту разрешается иметь на экзамене листок
с формулами при условии, что студент может
объяснить значение каждой величины, входящей в
формулу.
2. Особое внимание обращайте на качество рассказа
или объяснения. Студент должен говорить, а не
молчать!
3. Листы подготовки должны быть написаны
аккуратно, разборчивым почерком. На листе должен
быть отражен план ответа.
4. Если студент не успел решить задачу,
допускается (без снижения оценки) подробное
объяснение хода решения.
5. Рекомендуются дополнительные вопросы из
следующих разделов: изобарный потенциал,
электродный потенциал, рН, ПР,
уравнение гидролиза иона сокращенным способом,
расчет рН растворов кислот, оснований, солей,
энергия активации,
порядок реакции, зависимость скорости реакции от
концентрации реагирующих веществ, принцип Ле
Шателье, подбор
коэффициентов в уравнениях
окислительно-восстановительных реакций
электронно-ионным методом, окисление
перманганатом калия в различных средах,
распределение электронов по уровням и
подуровням, предсказание валентности
(“спиновой”) и написание простейших формул
соединений.
После сдачи экзамена преподаватель
оставляет у себя листы подготовки к ответу и
практикантскую книжку с экзаменационной
отметкой.
СТУДЕНТЫ ПРИХОДЯТ НА ЭКЗАМЕН К 9.30-10.00,
ПРЕПОДАВАТЕЛИ - К 10.15-10.30.
СОДЕРЖАНИЕ ЭКЗАМЕНА
Экзамен - проверка знаний,
позволяющая судить об эффективности усвоения
изученного курса.
Содержание экзаменационных вопросов и
задач соответствует программе курса, которой
студенты пользуются в течение всего периода
изучения данной дисциплины, при подготовке к
экзамену и в процессе сдачи экзамена.
Экзаменационный билет состоит из трех вопросов и
задачи. Каждый вопрос билета ставит своей целью
выявить знания по одному из важнейших учений
общей химии: о строении вещества, направлении
химических процессов (химическая термодинамика),
скорости химических процессов (химическая
кинетика) и о периодическом изменении свойств
элементов и их соединений. Задача посвящена
расчету из области химической термодинамики или
химической кинетики.
Экзамен проводится в форме свободной беседы
экзаменатора со студентом по темам
экзаменационных вопросов. Оценка знаний
осуществляется в зависимости от качества
научной речи студента, при этом в первую очередь
учитывается следующее:
1. При объяснении любого явления необходимо
подходить к нему системно, т.е. включать знания из
всех четырех основных
учений химии, из различных теорий, объединяя
приобретенные и ранее известные сведения.
2. При описании и объяснении химических явлений
следует использовать научные данные своей
основной специальности и
показывать приложение химических знаний к ней.
3. Формулировки законов, принципов, правил и
определения понятий могут быть даны своими
словами, но при этом должна
соблюдаться научная строгость.
4. При объяснении законов, принципов, правил и
формул необходимо указывать границы их
применимости (ограничения и
области действия).
5. При определении понятия должны быть указаны
его существенные признаки.
6. При описании факторов, влияющих на прохождение
процессов или свойства объекта, следует
располагать факторы в
порядке понижения их значимости.
7. Любая формула должна быть объяснена и указан
смысл ее членов и область применения.
8. При описании химического понятия указываются
его существенные признаки, сходства и отличия.
При объяснении
раскрываются связи данного явления с другими и
показывается их устойчивый, закономерный
характер. Следует как
можно чаще пользоваться сравнениями, различиями
и аналогиями.
9. Одним из положительных качеств ответа является
привлечение максимального числа научных
терминов, понятий и
представлений.
10. Рассказ должен быть логически стройным. Этим
же требованиям должно удовлетворять объяснение
решения задачи.
Несмотря на то, что при сдаче экзамена основное
внимание обращается на уровень развития
химического мышления, есть целый ряд вопросов,
которые необходимо знать в качестве опоры для
создания новых знаний. Это формулировки законов,
принципов, правил, содержание (суть) важнейших
теорий, определения понятий, ряд формул и их
анализ, численные значения некоторых постоянных.
Сюда же относятся и умение, т.е. действие на
основании законов, формул и т.п., которые должны
приводить к решению задач.
Ниже приводится примерный перечень законов,
правил, определений и формул, которые необходимо
знать (формулировка, объяснение, границы
применения, область использования), а также
дается сводка умений, которыми должен владеть
студент после прохождения курса общей химии. Все
ниже перечисленное может служить в качестве
ополнительных вопросов на экзамене!
а) теории, законы, правила, определения и
понятия
внутренняя энергия
энтальпия
энтропия
энергия Гиббса
энергия Гельмгольца
константа равновесия процесса
закон Гесса
скорость химической реакции
факторы, влияющие на скорость реакции
закон действующих масс
правило Вант-Гоффа и границы его применимости
уравнение Аррениуса
энергия активации
катализ
катализатор
основное уравнение химической кинетики
способы выражения концентрации растворов
закон Рауля
осмотическое давление
ионная сила раствора
активность
ионное произведение воды
водородный показатель
формула Нернста
двойной электрический слой
законы Фарадея
растворимость
произведение растворимости
условия образования и растворения осадков
периодический закон Д.И.Менделеева
квантовые числа
принцип запрета Паули
правило Гунда
правило Клечковского
период
группа элементов
форма s-, p-, d-атомных орбиталей
сигма- и пи-связи
суть теории валентных связей
суть теории молекулярных орбиталей
водородная связь
металлическая связь
суть теории кристаллического поля
координационные числа Fe, Mn, Co, Ni, Cu, Zn, Ag, Pt
примеры сильных и слабых лигандов
б) формулы
 H = H =  U + p U + p V = V =  U + U + nRT nRT
 G = G =  H – T H – T S S
 F = F =  U – T U – T S S
 Go = – RT ln K Go = – RT ln K
 Fo = – RT ln K Fo = – RT ln K
 G = G =  F + p F + p V = V =  F + F + nRT nRT
 G = – Ap G = – Ap
 F = – Av F = – Av
C = K – f + n
S = R lnW
pV = nRT
V = ± 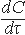
V = k .
CAa · CBb · CBd
Реакции нулевого порядка: V = k; k =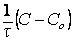 ; ; 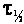 = = 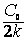
Реакции первого порядка: V = kC; k = 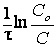 ; t1/2 = ; t1/2 = 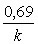
Реакции второго порядка: V = kC2 ; k
= 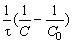
k = A. e–E/RT
k = Z . e –E/RT· eS/R
E = Eo – 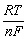 ln ln 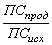
lg K = 16,9 · n Eo Eo
pH = – lg[H+]
I = -1/2 ci z i2 ; a
= f · C ; lgf = –0,5 z2 ci z i2 ; a
= f · C ; lgf = –0,5 z2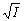
Еа = 19,14 lg 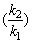 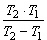
в) умения:
1. Изобразить и выразить формулой распределение
электронов по уровням и подуровням в
невозбужденном и возбужденном атоме.
2. Нарисовать модели простейших молекул (метан,
этан, этилен, ацетилен, вода, аммиак,
селеноводород, сероводород и др.) и ионов
(аммония, гидроксония и др.)
3. Предсказать тип гибридизации атомных
орбиталей атома по величине валентного угла.
4. Вычислить энергию связи двухатомной молекулы
по константам диссоциации при различных
температурах.
5. Составить формулу комплексной соли и назвать
ее.
6. Предсказать магнитные свойства комплексного
иона в зависимости от силы поля лигандов.
7. Определить типы связей в молекуле и кристалле.
8. Вычислить мольную массу газообразного
вещества.
9. Вычислить работу химической реакции.
10. Нарисовать простейшую энтальпийную диаграмму
химической реакции.
11. Предсказать смещение равновесия при изменении
внешних условий.
12. Записать выражение для константы равновесия в
гомогенных и гетерогенных системах.
13. Рассчитать  Ho, Ho,  So, So,  Go химической реакции по Go химической реакции по  Hoобр., So, Hoобр., So,  Goобр ее участников. Goобр ее участников.
14. Рассчитать  Go298 реакции и
предсказать возможность ее протекания при
других температурах. Go298 реакции и
предсказать возможность ее протекания при
других температурах.
15. Предсказать возможность протекания реакции
при нестандартных условиях.
16. Рассчитать изменение энтропии при фазовом
превращении.
17. Вычислить энтальпию фазового перехода,
воспользовавшись энтальпиями сгорания.
18. Вычислить число степеней свободы для
простейших диаграмм состояния.
19. Нарисовать и объяснить диаграмму состояния
воды.
20. Нарисовать и объяснить диаграммы состояния
двухкомпонентных систем с полной взаимной
растворимостью и полной
взаимной нерастворимостью.
21. Предсказать вид кривой нагревания и
охлаждения для простейших однокомпонентных и
двухкомпонентных систем.
22. По известному порядку реакции рассчитать
изменение скорости реакции в зависимости от
изменения концентрации или
давления.
23. Рассчитать константу скорости по
экспериментальным значениям скорости.
24. Рассчитать период полураспада.
25. Рассчитать энергию активации по времени
прохождения реакции при разных температурах.
26. Рассчитать концентрацию раствора.
27. Рассчитать понижение температуры замерзания
раствора.
28. Рассчитать мольную массу или степень
диссоциации растворенного вещества.
29. Рассчитать активность иона в растворе.
30. Рассчитать рН растворов кислот, оснований и
солей.
31. Записать уравнение реакции гидролиза
сокращенным молекулярно-ионным способом и
предсказать рН раствора соли.
32. Записать уравнения реакций перехода типа: цинк
(II)  цинкат-ион, хромат-ион цинкат-ион, хромат-ион  дихромат-ион и наоборот.
дихромат-ион и наоборот.
33. Рассчитать концентрации ионов в растворах
комплексных солей.
34. Рассчитать ЭДС гальванического элемента.
35. Предсказать направление
окислительно-восстановительной реакции.
36. Рассчитать количество вещества, выделившегося
при электролизе.
37. Записать формулу гранулы и мицеллы.
38. Рассчитать ПР по растворимости и наоборот.
39. Рассчитать растворимость по известной
величине ПР, концентрации общего иона и величине
ионной силы раствора.
40. Рассчитать термодинамические характеристики
процесса растворения по растворимости при
различных температурах.
41. Предсказать характер изменения следующих
свойств элементов и их соединений при переходе
по подгруппе и по
периоду:
а) ионизационный потенциал атома;
б) сродство к электрону атома;
в) энергия связи двухатомной молекулы;
г) угол между связями в двухатомной молекуле;
д) магнитные свойства молекул и молекулярных
ионов элементов II-го периода и комплексных ионов
d-элементов IV
периода;
е) кислотные и основные свойства оксидов и
гидроксидов;
ж) окислительно-восстановительные свойства;
з) стандартная энтальпия образования;
и) стандартная энтропия;
к) изобарный потенциал реакции;
л) скорость однотипных реакций.
42. Предсказать оптимальные условия прохождения
реакции.
43. Системно описать вещество и химический
процесс.
|

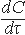
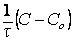 ;
; 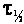 =
= 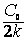
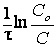 ; t1/2 =
; t1/2 = 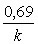
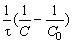
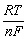 ln
ln