|
Учебные материалы по неорганической химии
Неорганические синтезы. Практикум для студентов 1-го курса (сборник методик)
СИНТЕЗ ТРИБРОМИДА ФОСФОРА
Ознакомиться по любому доступному Вам
справочнику с физическими и физико-химическими
свойствами исходных и синтезируемых Вами
веществ. Напишите уравнения реакций.
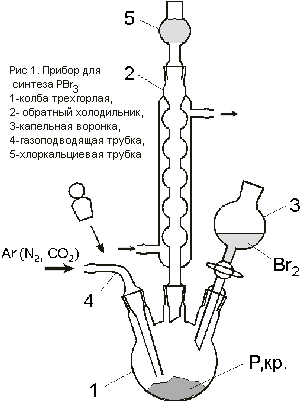 Собрать
прибор, изображенный на рис.1 и состоящий из
трехгорлой колбы, обратного холодильника,
капельной воронки и газоподводящей трубки. В
колбу поместить 2,5 г очищенного и сухого
красного фосфора. Вытеснить воздух из колбы
током сухого инертного газа (Ar, N2, CO2),
после чего заменить газоподводящую трубку
стеклянной пробкой. В капельную воронку ввести
сухой бром в количестве, рассчитанном по
уравнению реакции с недостатком 15%. Работать с
бромом можно только под тягой в перчатках и
защитных очках. Бром ядовит и вызывает
труднозаживающие химические ожоги, ПДК паров
брома в воздухе 0,5 мг/м3. При попадании
брома на кожу немедленно промыть 10% раствором
тиосульфата натрия или раствором Na2CO3.
При случайном вдыхании паров брома
пострадавшеего немедленно вывести на свежий
воздух и дать подышать парами этанола (ватка,
смоченная спиртом). Напишите уравнения реакций
нейтрализации брома. Собрать
прибор, изображенный на рис.1 и состоящий из
трехгорлой колбы, обратного холодильника,
капельной воронки и газоподводящей трубки. В
колбу поместить 2,5 г очищенного и сухого
красного фосфора. Вытеснить воздух из колбы
током сухого инертного газа (Ar, N2, CO2),
после чего заменить газоподводящую трубку
стеклянной пробкой. В капельную воронку ввести
сухой бром в количестве, рассчитанном по
уравнению реакции с недостатком 15%. Работать с
бромом можно только под тягой в перчатках и
защитных очках. Бром ядовит и вызывает
труднозаживающие химические ожоги, ПДК паров
брома в воздухе 0,5 мг/м3. При попадании
брома на кожу немедленно промыть 10% раствором
тиосульфата натрия или раствором Na2CO3.
При случайном вдыхании паров брома
пострадавшеего немедленно вывести на свежий
воздух и дать подышать парами этанола (ватка,
смоченная спиртом). Напишите уравнения реакций
нейтрализации брома.
Небольшими порциями ввести бром в колбу. В
начале эксперимента бром следует приливать
очень осторожно - по каплям. По мере образования
на дне колбы жидкого трибромида фосфора скорость
приливания брома можно несколько увеличить.
Содержимое колбы необходимо время от времени
перемешивать осторожным покачиванием штатива.
Наряду с образованием трибромида фосфора
получаются PBr5 и PBr7 (кристаллы желтого
и красного цвета, оседающие на стенках колбы). Для
их удаления необходимо периодически осторожно
нагревать слабым пламенем горелки стенки колбы.
Окончанием синтеза считать исчезновение паров
брома в колбе.
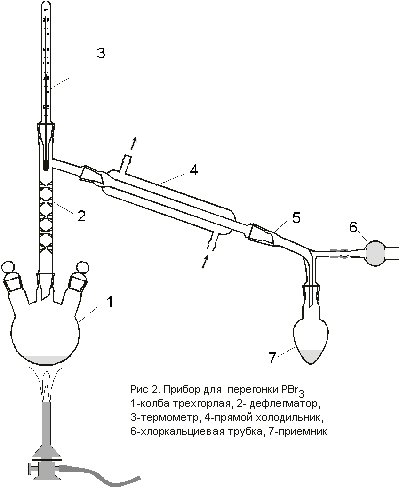
Заменить капельную воронку дефлегматором с
термометром и холодильником. Осторожно нагреть
колбу пламенем газовой горелки. Собрать фракцию,
кипящую при 172 – 174o С в приемник (Рис. 2).
Если отогнанный препарат окрашен парами брома,
следует перенести его в прибор для перегонки,
добавить туда 0,2 – 0,3 г красного фосфора и еще
раз перегнать.
Полученный продукт перенести во взвешенн ую
оттянутую пробирку и запаять (очки!). Взвесить
пробирку с веществом и рассчитать выход в
процентах.
Промыть приемники, в которых находился
трибромид фосфора водой. Определить рН
полученного раствора. Написать уравнение
реакции. С помощью химических реакций
подтвердить состав прдуктов гидролиза
Реактивы: 1. Фосфор – 2,5 г. 2. Бром.
Оборудование: 1. Колба трехгорлая. 2. Обратный
холодильник. 3. Капельная воронка.
4. Дефлегматор. 5. Термометр. 6. Прямой холодильник.
Рекомендованная литература: 1. Практикум по
неорганической химии /ред В.П.Зломанов, М.: МГУ, 1994.
2. Руководство по неорганическому синтезу /Ред
Г.Брауэр, М.: Мир, 1985, Т.3.
|

 Собрать
прибор, изображенный на рис.1 и состоящий из
трехгорлой колбы, обратного холодильника,
капельной воронки и газоподводящей трубки. В
колбу поместить 2,5 г очищенного и сухого
красного фосфора. Вытеснить воздух из колбы
током сухого инертного газа (Ar, N2, CO2),
после чего заменить газоподводящую трубку
стеклянной пробкой. В капельную воронку ввести
сухой бром в количестве, рассчитанном по
уравнению реакции с недостатком 15%. Работать с
бромом можно только под тягой в перчатках и
защитных очках. Бром ядовит и вызывает
труднозаживающие химические ожоги, ПДК паров
брома в воздухе 0,5 мг/м3. При попадании
брома на кожу немедленно промыть 10% раствором
тиосульфата натрия или раствором Na2CO3.
При случайном вдыхании паров брома
пострадавшеего немедленно вывести на свежий
воздух и дать подышать парами этанола (ватка,
смоченная спиртом). Напишите уравнения реакций
нейтрализации брома.
Собрать
прибор, изображенный на рис.1 и состоящий из
трехгорлой колбы, обратного холодильника,
капельной воронки и газоподводящей трубки. В
колбу поместить 2,5 г очищенного и сухого
красного фосфора. Вытеснить воздух из колбы
током сухого инертного газа (Ar, N2, CO2),
после чего заменить газоподводящую трубку
стеклянной пробкой. В капельную воронку ввести
сухой бром в количестве, рассчитанном по
уравнению реакции с недостатком 15%. Работать с
бромом можно только под тягой в перчатках и
защитных очках. Бром ядовит и вызывает
труднозаживающие химические ожоги, ПДК паров
брома в воздухе 0,5 мг/м3. При попадании
брома на кожу немедленно промыть 10% раствором
тиосульфата натрия или раствором Na2CO3.
При случайном вдыхании паров брома
пострадавшеего немедленно вывести на свежий
воздух и дать подышать парами этанола (ватка,
смоченная спиртом). Напишите уравнения реакций
нейтрализации брома. 