|
Учебные материалы по неорганической химии
Неорганические синтезы. Практикум для студентов 1-го курса (сборник методик)
СИНТЕЗ СУЛЬФАТА ГИДРАЗИНА
Ознакомиться по любому доступному Вам
справочнику с физическими и физико-химическими
свойствами используемых и синтезируемых Вами
веществ, а также промежуточных продуктов
реакции. Напишите уравнения реакций.
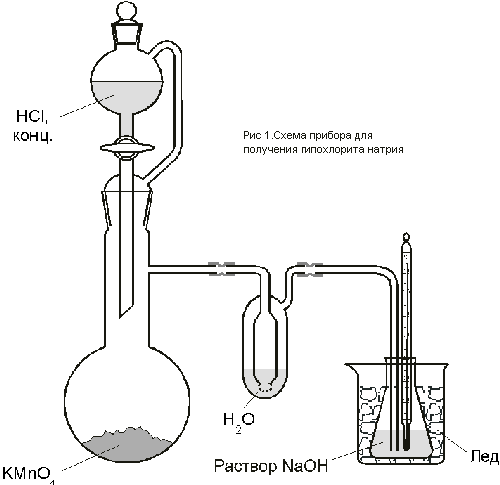
В колбу емкостью 200 мл поместить раствор
гидроксида натрия (8 г гидроксида натрия
растворено в 35 мл воды). Колбу поместить в
баню со льдом. В охлаждаемый раствор пропускать в
течение 1 – 1,5 часа ток хлора (рис.1) до прекращения
поглощения. (Под тягой! Хлор смертельно опасен,
при концентрации выше 0,1 мг/л вызывает
рефлекторный паралич дыхания. ПДК в рабочей
зоне 1,0 мг/м3). Температура раствора во
время хлорирования не должна превышать 5o С.
Полноту поглощения хлора определяют
периодическим взвешиванием колбы. Сколько хлора
должно быть поглощено?
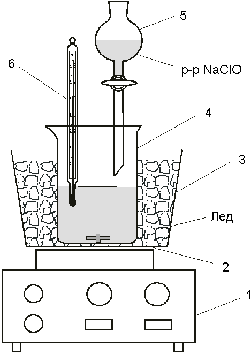 |
В стакан емкостью 150 мл налить
10 мл 35%-го раствора гидроксида натрия. При
перемешивании стеклянной палочкой внести в
стакан раствор 0,1 г MnSO4* 5H2O или 0,03 г
MnCl2* 4H2O в 1 мл воды и 2,5 г
мочевины. Охладить стакан в пластмассовой бане
смесью льда с поваренной солью, после чего
поставить баню со стаканом на магнитную мешалку
и включить её (рис.2).
|
Рис 2.Получение гидроксида гидразина
1-Магнитная мешалка, 2-активатор, 3-баня со льдом,
4-стакан, 5-капельная воронка, 6-термометр |
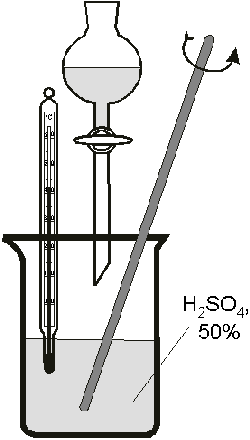
Постепенно ввести в раствор из капельной
воронки 21 мл охлажденного раствора
гипохлорита натрия. Температура даже в конце
реакции не должна подниматься выше 10o С.
Убрать баню со льдом, включить нагрев на
магнитной мешалке и медленно (2o в минуту)
нагреть до 60o С. Снять стакан с раствором с
мешалки и оставить под тягой до следующего дня.В
фарфоровый стакан (рис.3) налить 25 мл 50%-го
раствора серной кислоты. Укрепить над стаканом
капельную воронку, в которую перелить полученный
накануне раствор и прикапывать его при
интенсивном перамешивании стеклянной палочкой в
фарфоровый стакан (надеть очки!). Температура при
этом не должна подниматься выше 40 – 50o С. По
окончании прикапывания раствор охладить до 22 – 25o
С.
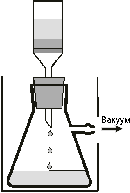
Отфильтровать выпавший сульфат гидразина под
пониженным давлением на стеклянном фильтре N2 или
N3 (очки!), последовательно промыть вещество
два раза охлажденной водой, спиртом и эфиром
(порциями по 5 мл). Сухое вещество взвесить и
рассчитать выход в процентах.
Чем может быть загрязнен полученный препарат и
как его очистить?
Часть кристаллов растворить в воде и доказать
присутствие сульфата гидразина. Напишите
уравнения реакций.
Реактивы: 1. Мочевина – 3,5 г. 2. Перманганат
калия – 30 г. 3. Хлористоводородная кислота
(конц.) – 60 мл. 4. Гидроксид натрия – 25 г.
Оборудование: 1. Прибор для получения сухого
хлора. 2. Стеклянный стакан емкостью 150 мл. 3.
Фарфоровый стакан емкостью 150 мл. 4. Магнитная
мешалка.
Рекомендованная литература: 1. Практикум по
неорганической химии /ред В.П.Зломанов, М.: МГУ, 1994.
2. Н.В.Коровин. Гидразин. М: 1980.
|




