Школьные олимпиады по химии
Всероссийская олимпиада школьников по химии - 2004 года
Всероссийская олимпиада школьников по химии - 2004 года
Практический тур
ДЕВЯТЫЙ КЛАСС
Дана точная навеска смеси карбонатов кальция и
натрия. Используя имеющиеся на столе реактивы и
оборудование, определите массовую долю ( % )
каждого из карбонатов в данной смеси. Составьте
план выполнения определения. Напишите уравнение
реакции.
Реактивы: 0,1 MHCl, 0.1 MNaOH, индикаторы:
фенолфталеин 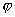 рН
8-10, метиловый оранжевый
рН
8-10, метиловый оранжевый  рН
3,1-4,4.
рН
3,1-4,4.
Оборудование: бюретка 25 мл 2шт., пипетка Мора
10мл, колбы для титрования 100мл 2 шт., стакан 100 (50)мл,
воронка, мерная колба на 100 мл, электроплитка или
водяная баня, бумажный фильтр, глазная пипетка.
РЕШЕНИЕ
Навеску смеси переносят в термостойкий стакан
объёмом 100-200мл, добавляют 20-30мл дистиллированной
воды и нагревают до слабого кипения. Горячий
раствор сливают через бумажный фильтр и собирают
в мерную колбу объёмом 100мл. Находящийся в
стакане и частично попавший на фильтр СаСО3
несколько раз промывают дистиллированной водой
собирая промывные воды в мерную колбу. Раствор в
колбе доводят до метки дистиллированной водой. В
этом растворе определяют Nа2СО3.
ОПРЕДЕЛЕНИЕ Nа2СО3.
Na2CO3 + 2HCl= 2NaCl+ CO2 + 2H2O
+ 2H2O
10 мл раствора из мерной колбы переносят в колбу
для титрования, добавляют 2 капли индикатора
метилового – оранжевого и титруют раствором
НСlдо изменения окраски раствора от жёлтой к
оранжевой. Массовую долю Na2CO3
вычисляют по формуле:
 (%), где
(%), где  %
- массовая доля Na2CO3
%
- массовая доля Na2CO3
VHCl - объём HCl, израсходованный на
титрование, мл
CHCl - концентрация HCl , моль/л
M(Na2CO3)- молярная масса Na2CO3
– 106 г/моль
а - навеска образца, г
Vк – объём колбы 100 мл
Vn - объём пипетки 10 мл
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ СаСО3
CaCO3 + 2HCl= CaCl2 + CO2 + H2O
+ H2O
HCl + NaOH = NaCl + H2O
Фильтр с попавшей на него частью CaCO3
переносят в стакан, в котором находится основная
часть CaCO3, добавляют из бюретки точно
отмеренный объем раствора HCl, необходимый для
полного растворения и ещё некоторый её избыток (~
50% от прибавленного объёма). Содержимое стакана
нагревают до кипения (для удаления СО2).
Раствор охлаждают и избыток кислоты
оттитровывают стандартным раствором NaOH в
присутствии индикатора фенолфталеина до
изменения окраски раствора от бесцветной до
бледно-розовой. Массовую долю CaCO3
определяют по формуле:
 (%), где
(%), где
 CaCO3% – массовая доля CaCO3.
CaCO3% – массовая доля CaCO3.
CHCl, CNaOH – концентрация HClи NaOH, моль/л
VHCl – объём HCl, добавленный к навеске
карбонатов, мл
VNaOH – объём NaOH, израсходованный на
титрование, мл
M(CaCO3) - молярная масса CaCO3 – 100,1 г/моль
а – масса исходной навески, г
ДЕСЯТЫЙ КЛАСС
Определить содержание алюминия в граммах в
выданном вам растворе. Предложите методику
определения. Обоснуйте условия определения
(выбор рН раствора при титровании и способ
титрования).
Реактивы: ~0.025 ЭДТА
(этилендиаминтетрауксусная кислота, Na2H2Y),
0.025 MZnSO4, аммиачный буферный раствор рН-9-10,
ацетатный буферный раствор рН 4-5, эриохромовый
чёрный Т, ксиленоловый оранжевый, универсальная
индикаторная бумага.
Оборудование: бюретка на 25 мл – 1шт, пипетка
Мора 10 мл - 1шт, колбы для титрования
на 100 мл - 1-2 шт, воронка, эл.- плитка, мерный цилиндр
на 10 мл - 2 шт.
РЕШЕНИЕ
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРА ЭДТА
При рН 9-10 ЭДТА находится в форме HY3-:
Zn2+ + HY3- = ZnY2- + H+
10 мл раствора ZnSO4 переносят в колбу для
титрования, добавляют 10 мл аммиачного буферного
раствора, эриохромового чёрного Т на кончике
шпателя, перемешивают раствор до полного
растворения индикатора и титруют раствором ЭДТА
до изменения окраски раствора от
красно-фиолетовой до синей. Получают три
сходящихся результата.
Расчёт концентрации ЭДТА проводят по формуле:
 (моль/л), где
(моль/л), где
СЭДТА - концентрация ЭДТА , моль/л
С(ZnSO4) - концентрация ZnSO4 ,моль/л
V(ZnSO4) - объём ZnSO4 , взятый для
титрования, мл
VЭДТА - объём ЭДТА , израсходованный на
титрование, мл
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ АЛЮМИНИЯ В ВЫДАННОМ РАСТВОРЕ
При рН 4-5 ЭДТА находится в форме H2Y2-
Al3+ + H2Y2-изб. = AlY-
+ H2Y2-ост.
H2Y2- + Zn2+ = ZnY2- + 2H+
Раствор задачи в мерной колбе, доводят до метки
дистиллированной водой и тщательно
перемешивают. В колбу для титрования переносят 10
мл раствора, добавляют 20 мл раствора ЭДТА, 10мл
ацетатного буферного раствора с рН 5, нагревают до
кипения и оставляют на 5 мин. После охлаждения
раствора добавляют на кончике шпателя индикатор
ксиленоловый оранжевый и после полного
растворения индикатора титруют раствором ZnSO4 до
изменения окраски раствора от жёлтой к красной.
Получают три сходящихся результата. Расчёт
проводят по формуле:
 (г), где
(г), где
m(Al)– масса Alв гр, в выданном растворе
CЭДТА – концентрация ЭДТА, моль/л
VЭДТА - объём ЭДТА (20 мл), добавленный к
пробе.
V(ZnSO4) - объём ZnSO4,
израсходованный на титрование, мл.
C(ZnSO4) - концентрация ZnSO4, моль/л
M(Al) - молярная масса эквивалента алюминия, равная
его молярной массе - 26,98 г/моль
Vk- объём мерной колбы – 100 мл
Vn- объём пипетки – 10 мл
ОТВЕТЫ НА ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Определение ионов Al3+ проводят способом
обратного титрования, т. к. скорость реакции
взаимодействия ЭДТА с ионами Al3+ очень мала,
нагревание раствора повышает скорость реакции.
Определение алюминия проводят при рН = 4-5, т. к. при
увеличении рН раствора начинается гидролиз
ионов алюминия.
ОДИННАДЦАТЫЙ КЛАСС
Задание: Используя имеющиеся на столе
реактивы и оборудование, определить содержание
K2Cr2O7 и Cr2(SO4)3 в
граммах в выданном вам растворе. Предложите
методику определения.
Напишите уравнения реакций.
Реактивы: 0.05 MNa2S2O3, 1 MH2SO4,
KI тв., 2 MNaOH 5% - ный р-р Н2О2, 1%-ный р-р
крахмала, универсальная индикаторная бумага.
Оборудование: бюретка на 25 мл, пипетка Мора
на 10 мл, колбы для титрования – 2 шт.,
мерная колба на 100 мл, воронка, часовые стёкла,
мерный цилиндр на 20 мл – 2 шт., электроплитка.
РЕШЕНИЕ
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ K2Cr2O7.
K2Cr2O7 + 6KI + 7H2SO4
= Cr2(SO4)3 + 3I2 + 4K2SO4
+ 7H2O
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Раствор задачи в мерной колбе доводят до метки
дистиллированной водой и перемешивают. 10 мл
раствора переносят в колбу для титрования,
добавляют 10 мл 1М H2SO4, ~1г. KI тв.,
накрывают колбу часовым стеклом, перемешивают и
дают постоять 5 – 10 мин. в тёмном месте.
Выделившийся йод титруют раствором Na2S2O3
до бледно-жёлтой окраски, затем добавляют 1 – 2 мл
крахмала и дотитровывают до светло- зелёной
окраски раствора. Получают три сходящихся
результата.
Расчёт проводят по формуле:
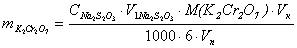 (г)
(г)
m(K2Cr2O7) – содержание K2Cr2O7
в объёме колбы (г)
С(Na2S2O3) - концентрация Na2S2O3,
моль/л
V1Na2S2O3 - объём Na2S2O3,
израсходованный на титрование K2Cr2O7,
мл
M(K2Cr2O7) - молярная масса K2Cr2O7
– 294 г/моль
Vk – объём колбы – 100 мл
Vп - объём пипетки – 10 мл
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ Cr2(SO4)3.
10 мл раствора, содержащего задачу, переносят в
колбу для титрования, добавляют 15 мл NaOH, 5 – 6 мл Н2О2,
раствор кипятят ~ 5 мин. до получения жёлтой
окраски. Раствор охлаждают, добавляют 15 – 20 мл H2SO4
(рН раствора должно быть 5 – 7, проверяют с помощью
индикаторной бумаги). Затем добавляют ~ 1 г KI,
накрывают часовым стеклом, перемешивают и
оставляют на 5 – 10 мин. в тёмном месте.
Выделившийся йод титруют раствором тиосульфата
натрия до бледно – жёлтой окраски, добавляют 1 – 2
мл крахмала и дотитровывают раствор до появления
светло – зелёной окраски. Получают три
сходящихся результата.
Окисление хрома ( III ) происходит по реакции:
Cr2(SO4)3 + 3H2O2
+ 10NaOH = 2Na2CrO4 + 3Na2SO4 + 8H2O
2Na2CrO4 + H2SO4 = Na2Cr2O7
+ Na2SO4 + H2O
Расчётсодержания Cr2(SO4)3
проводят по формуле:
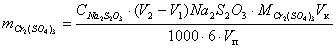 (г)
(г)
m(Cr2(SO4)3)– содержание Cr2(SO4)3
в объёме колбы, г
C(Na2S2O3)- концентрация Na2S2O3,
моль/л
V2 - объём Na2S2O3,
израсходованный на титрование суммы K2Cr2O7
и Cr2(SO4)3, мл
V1 - объём Na2S2O3,
израсходованный на титрование K2Cr2O7,
мл
M(Cr2(SO4)3)- молярная масса Cr2(SO4)3
– 392 г/моль
Vk – объём колбы – 100 мл
Vп - объём пипетки – 10 мл.


 рН
8-10, метиловый оранжевый
рН
8-10, метиловый оранжевый  рН
3,1-4,4.
рН
3,1-4,4. (%), где
(%), где  %
- массовая доля Na2CO3
%
- массовая доля Na2CO3 (%), где
(%), где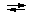 (моль/л), где
(моль/л), где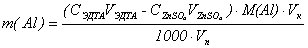 (г), где
(г), где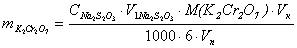 (г)
(г) (г)
(г)