| Предыдущая задача | Содержание | Следующая задача | 38-ая Международная Химическая Олимпиада Тренировочные задачи |
Ферменты – катализаторы реакций в живых организмах. Они устроены так, что выполняют свои функции максимально эффективно. Активный центр фермента, состоящий из аминокислотных остатков, очень эффективно организует пространство для переходного состояния (ПС) реакции, и, следовательно, значительно понижает энергию активации и ускоряет реакцию. Если бы можно было рассчитать константу связывания ПС ферментом, то это позволило бы количественно определить эффективность фермента как отношение констант скорости kкат/kнекат.
Искусственные ферменты находятся под пристальным вниманием ученых, так как, во-первых, они проливают свет на поведение природных ферментов, а, во-вторых, могут быть использованы для синтетических или терапевтических целей. Антитела-катализаторы являются примером таких ферментов. Антитела имеют участки связывания с антигеном, причем связывание характеризуется высоким сродством (KD= 10–9 – 10–11M) и специфичностью. Эти свойства могут быть использованы для создания активных участков в искусственных ферментах. Антиген-связывающие участки могут быть использованы для распознавания субстратов и проведения определенных реакций.
Так как антитела-катализаторы должны приспосабливаться к ПС, то антигены, запускающие производство антитела-катализатора, должны иметь схожие с ПС структурные параметры. Но химики не могут получить ПС, так как они неустойчивы. Вместо ПС можно синтезировать устойчивое соединение, повторяющее его структурные параметры. Такое соединение называют аналогом переходного состояния (АПС). Полученный АПС может быть введен мышам для получения антител. Период полураспада АПС при физиологических условиях должен быть не менее двух недель для формирования иммунного отклика. Наиболее специфичные из антител отбираются как кандидаты в антитела-катализаторы.
28-1. Если одно из отобранных антител имеет KD = 10–13M по отношению к АПС, а нормальное антитело имеет KD = 10–6M, то какова энергия стабилизации АПС при связывании с этим антителом?
28-2. Предположим, что АПС действительно является переходным состоянием. Во сколько раз увеличится константа скорости реакции (kкат/kнекат), если мы используем это антитело как катализатор химического превращения?
Многие ученые заинтересованы в специфичном гидролизе патогенных белков или пептидов, таких как, например, β-амилоид. Эту реакцию можно катализировать антителами. Предполагая, что приведенная ниже реакция катализируется антителами, можно, зная конфигурацию ПС, сконструировать его подходящий аналог.
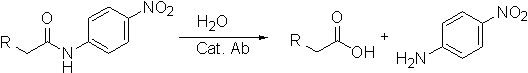
28-3. Что собой представляет переходное состояние или реакционный интермедиат в приведенной выше реакции гидролиза амидной связи?
28-4. Предложите стабильный АПС, пригодный для замещения ПС. Помните, что АПС должен быть стабильным и схожим с ПС по структуре.
Ответ
28-1. 41.6 кДж/моль.
28-2. 1×107.