Задачи 1-5
Задача 1. Вода
Задача 2. Газы Ван-дер-Ваальса
Задача 3. Скорости и механизмы реакций
Задача 4. Ферментативный катализ
Задача 5. Уравнение Шредингера
Задача 1. Вода
Вода - самое распространенное вещество в
окружающей среде - прекрасная система для
демонстрации многих понятий термодинамики. Она
может существует в трех фазах: твердой (лед),
жидкой и газообразной. [При высоких давлениях
существует несколько различных модификаций
льда, но это выходит за рамки задачи]. Фазовая
диаграмма воды, которая описывает зависимость
равновесного давления от температуры для
различных фаз, имеет вид:
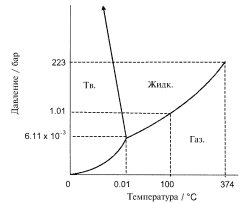
А. Фазовая диаграмма

Фазовая диаграмма воды (без масштаба)
а. При каких температуре и давлении все три фазы воды находятся в равновесии?
б. По диаграмме определите, как влияет понижение давления на температуру кипения воды и температуру плавления льда.
в. Кривая равновесия "жидкость-пар" заканчивается в точке Pc = 223 бар и Tc = 374 оС. Что означает эта точка?
г. Какая фаза воды устойчива при T = 300 K, P = 12.0 бар; T = 270 K, P = 1.00 бар?
д. Ниже какого давления лед при изобарном нагревании будет сублимироваться в пар?
е. При некоторых температуре и давлении на кривой "жидкость-пар" молярные объемы воды в двух фазах равны:
м3
м3.
Рассчитайте объемные доли воды жидкости и пара в сосуде объемом 0.100 л, содержащем 1.00 моль воды.
Б. Уравнение Клаузиуса-Клапейрона
а. Объясните ответ на вопрос А, б с помощью уравнения Клапейрона.
б. В автоклавах, используемых в медицине для стерилизации, вода должна кипеть при температуре 120 оС для того, чтобы убить большую часть бактерий. Оцените необходимое для этого давление. Мольная энтальпия испарения воды равна 40.66 кДж. моль-1 в нормальной точке кипения. Укажите, какие допущения вы использовали при оценке.
в. Мольная энтальпия плавления воды в нормальной точке замерзания (273.15 K) равна 6008 кДж. моль-1. Оцените давление, при котором вода и лед находятся в равновесии при температуре -0.200 оС. Плотность льда = 917 кг. м-3, плотность воды = 1000 кг. . м-3. Укажите, какие допущения вы использовали при оценке.
В. Необратимая конденсация
а. Возьмем 28.5 г переохлажденной (жидкой) воды при -12 оС и 1.00 бар. Находится ли это состояние в плоскости P - T на фазовой диаграмме?
б. Это метастабильное состояние внезапно переходит в лед при этих же температуре и давлении. Считая метастабильное состояние равновесным, рассчитайте, сколько теплоты выделится при этом. Мольные теплоемкости, которые можно считать постоянными, равны:
Дж. моль-1. К-1
Дж. моль-1. К-1
Дж. г-1
в. Определите общее изменение энтропии Вселенной в результате этого процесса и покажите, что этот результат подтверждает Второй Закон термодинамики. Температуру окружающей среды примите равной -12 оС.
Задача 2. Газы Ван-дер-Ваальса
Из уравнения состояния идеального газа PV = nRT следует, что фактор сжимаемости равен 1:
![]()
Однако, для реальных газов фактор сжимаемости отклоняется от 1. Для того, чтобы описать поведение реальных газов, Ван-дер-Ваальс предложил следующее уравнение состояния:
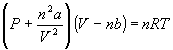 ,
,
где a и b - индивидуальные постоянные для газа. Постоянная a служит мерой межмолекулярного взаимодействия, а постоянная b связана с собственным размером молекул.
а. Используя уравнение Ван-дер-Ваальса, покажите, что:
1. При достаточно высоких температурах Z больше единицы при всех давлениях. При высоких температурах и низких давлениях Z стремится к значению идеального газа.
2. При низких температурах Z может быть меньше единицы.
3. При a = 0, Z линейно растет с ростом давления.
б. На рисунке приведена зависимость Z от P
при некоторой температуре для He и N2.
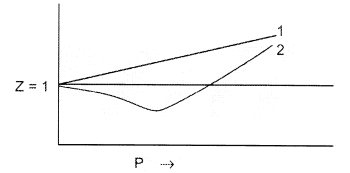
Для He, a = 3.46![]() 10-2 бар.
л2. моль-2, b = 2.38
10-2 бар.
л2. моль-2, b = 2.38![]() 10-2 л. моль-1.
10-2 л. моль-1.
Для N2, a = 1.37 бар. л2. моль-2,
b = 3.87![]() 10-2 л. моль-1.
10-2 л. моль-1.
Укажите, какой график соответствует He, а какой - N2.
в. На рисунке приведены две P-V изотермы газа Ван-дер-Ваальса. Укажите, какая из них соответствует температуре ниже критической (Tc) для данного газа.
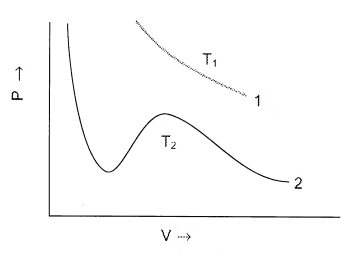
г. Для заданного P, три корня уравнения
Ван-дер-Ваальса сливаются при некоторой
температуре T = Tc. Выразите Tc
через a и b и, используя этот результат,
покажите, что N2 сжижается легче, чем He.
д. Определите работу, совершаемую одним молем
газообразного N2 при обратимом
изотермическом расширении от 1.00 л до 10.0 л.
Примите, что N2 описывается уравнением
Ван-дер-Ваальса.
Задача 3. Скорости и механизмы реакций
Одно и то же кинетическое уравнение для химической реакции может соответствовать нескольким разным механизмам. Для реакции
H2 + I2 ![]() 2HI
2HI
экспериментальное кинетическое уравнение имеет
вид:
![]()
В течение долгого времени полагали, что реакция
протекает так, как написано в уравнении, т.е., что
она представляется собой элементарную
бимолекулярную реакцию. В настоящее время
считают, что реакция может протекать по
нескольким механизмам. Ниже определенной
температуры предложены два альтернативных
механизма:
(1) I2 ![]() 2I (константа
равновесия K)
2I (константа
равновесия K)
k1 |
||
| I + I + H2 | 2HI |
(2) I2 ![]() (I2)d
(константа равновесия K')
(I2)d
(константа равновесия K')
k2 |
||
| (I2)d + H2 | 2HI |
где (I2)d представляет распадное (несвязанное) состояние I2. В каждом механизме первая стадия - быстрая, а вторая - медленная.
а. Покажите, что оба механизма
соответствуют экспериментальному кинетическому
уравнению.
б. В таблице приведены значения константы
скорости реакции k при двух температурах:
T (K) |
k (л. моль-1. с-1) |
373.15 |
8.74 |
473.15 |
9.53 |
1. Определите энергию активации Ea.
2. Энергия связи в молекуле I2 равна 151 кДж. моль-1. Объясните, почему вторая стадия в каждом механизме является лимитирующей.
в. Изменение внутренней энергии (![]() U) в суммарной реакции равно -8.2
кДж. моль-1. Определите энергию
активации обратной реакции.
U) в суммарной реакции равно -8.2
кДж. моль-1. Определите энергию
активации обратной реакции.
г. Энергия активации реакции бывает
отрицательной. Пример - рекомбинация атомов иода
в газовой фазе в присутствии аргона: I + I + Ar ![]() I2 + Ar, для которой энергия
активации примерно равна -6 кДж. моль-1.
I2 + Ar, для которой энергия
активации примерно равна -6 кДж. моль-1.
Один из возможных механизмов этой реакции: I + Ar + Ar
![]() IAr + Ar (константа равновесия K'')
IAr + Ar (константа равновесия K'')
k3 |
||
| IAr + I | I2 + Ar |
где IAr - очень слабо связанная молекула.
1. Предполагая, что вторая стадия - лимитирующая, выведите кинетическое уравнение для этой реакции.
2.Объясните, почему энергия активации для рекомбинации иода - отрицательная.
Задача 4. Ферментативный катализ
Ферменты играют ключевую роль во многих химических реакциях в живых организмах. Некоторые ферментативные реакции можно описать простым механизмом Михаэлиса-Ментен:
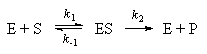
где E обозначает фермент, S - субстрат, на который действует фермент, а P - конечный продукт реакции.
Предположим, что вторая стадия необратима, а
равновесие на первой стадии устанавливается
очень быстро.
а.В эксперименте начальную скорость
(образования P) определяли при различных
концентрациях субстрата, поддерживая общую
концентрацию фермента постоянной и равной 1.5![]() 10-9 М. При этом получили
следующую зависимость:
10-9 М. При этом получили
следующую зависимость:
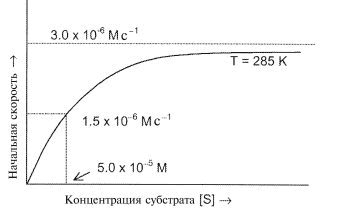
1. При малых [S] зависимость - линейная, а при больших [S] она стремится к постоянному значению. Покажите, что эти свойства соответствуют механизму Михаэлиса-Ментен. (Используйте приближение стационарных концентраций для промежуточного комплекса).
2. Определите константу скорости k2 для второй стадии.
3. На базе механизма Михаэлиса-Ментен предскажите начальную скорость реакции при концентрации субстрата [S] = 1.010-4 М.
4. Определите константу равновесия образования фермент-субстратного комплекса ES.
б. Описанный эксперимент, который был проведен при 285 К, повторили при другой температуре (310 К) с той же самой общей концентрацией фермента, и получили аналогичную кривую:
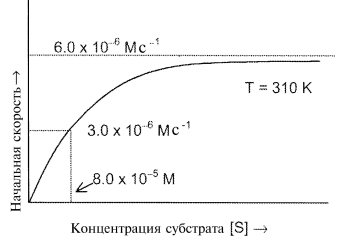
Определите энергию активации превращения ES в E и P
в. Интересное приложение ферментативного
катализа состоит в том, что ферменты
инактивируют антибиотики. Так, антибиотик
пенициллин инактивируется ферментом
пенициллиназой, выделяемым некоторыми
бактериями. Этот фермент имеет один активный
центр. Предположим для простоты, что данная
реакция описывается константами скорости,
определенными выше в п. а. Допустим также, что
доза 3 мкмоль антибиотика вызывает выделение 2.0![]() 10-6 мкмоль фермента в 1.00 мл
бактериальной суспензии.
10-6 мкмоль фермента в 1.00 мл
бактериальной суспензии.
1. Определите долю фермента, которая связывается с субстратом (пенициллином) на начальной стадии реакции.
2. Определите время, необходимое для инактивации 50% дозы антибиотика.
г. Предположим, что для управления
инактивацией пенициллина введено вещество,
которое имеет похожую на пенициллин структуру и
может занимать активный центр фермента, однако
не обладает биологической активностью. Это
приводит к ингибированию ферментативной
реакции. Степень ингибирования определяется
следующим образом:
![]() , где r и r0
- начальные скорости ингибируемой и
неингибируемой реакции, соответственно.
, где r и r0
- начальные скорости ингибируемой и
неингибируемой реакции, соответственно.
Рассмотрим следующий механизм ингибирования:
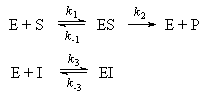
1. Покажите, что степень ингибирования понижается с увеличением концентрации субстрата (при постоянной концентрации ингибитора), и ингибитор становится неэффективным при больших концентрациях субстрата. (Такая механизм ингибирования называется конкурентным).
2. При низкой концентрации субстрата пенициллина определите, какая концентрация ингибитора вызовет понижение скорости инактивации пенициллина в 4 раза. Константа диссоциации комплекса "фермент-ингибитор" равна 5.010-5.
Задача 5. Уравнение Шредингера
Простейшее уравнение Шредингера, описывающее
частицу, которая свободно движется в одномерном
"жестком" ящике, имеет фундаментальное
свойство: граничные условия для волновой функции
приводят к квантованию некоторых величин.
а. Электрон массой m движется по оси x и
заперт между точками с координатами x = 0 и x
= L. Во всей этой области движение электрона -
свободное, на него не действуют никакие силы.
1. Напишите стационарное уравнение Шредингера для волновой функции электрона y .
2. Какие из перечисленных функций могут быть волновой функцией электрона в одномерном жестком ящике:
1)
2)
3)
4),где k - любое действительное число, а n - натуральное число?
3.Покажите, что волновым функциям из вопроса а.2 соответствует энергия
4. Изобразите графики волновых функций электрона в основном и в первых двух возбужденных состояниях. Какое число узлов (в области между x = 0 и x = L) имеет волновая функция с энергией En?
5.Нормируйте волновую функцию основного состояния электрона. (Интеграл от квадрата модуля нормированной волновой функции по всему пространству должен быть равен единице.)
б. Интересным примером использования этой
одномерной модели в химии служит описание
движения электрона по сопряженной системе
одинарных и двойных связей. Молекула бутадиена-1,3
имеет 4 ![]() -электрона, которые,
согласно этой модели, свободно двигаются по
линии, включающей три углерод-углеродные связи
примерно одинаковой длины (1.4
-электрона, которые,
согласно этой модели, свободно двигаются по
линии, включающей три углерод-углеродные связи
примерно одинаковой длины (1.4![]() 10-10
м) с добавлением отрезка 1.4
10-10
м) с добавлением отрезка 1.4![]() 10-10
м на каждом краю. Используя принцип наименьшей
энергии, изобразите схему заполнения
электронами энергетических уровней. Рассчитайте
наименьшую энергию возбуждения системы.
10-10
м на каждом краю. Используя принцип наименьшей
энергии, изобразите схему заполнения
электронами энергетических уровней. Рассчитайте
наименьшую энергию возбуждения системы.
в. Граничные условия для волновой функции
приводят к квантованию не только энергии, но и
других физических величин, таких как момент
импульса. Волновая функция, соответствующая
значению z-компоненты момента импульса Lz
= h![]() /2
/2![]() , имеет
вид:
, имеет
вид:
![]() ,
,
где f - (азимутальный) угол, описывающий положение
в плоскости x-y относительно оси x.
Покажите, что условие однозначности этой функции
в каждой точке пространства приводит к
квантованию ![]() . Определите
квантованные значения проекции момента импульса
на ось z.
. Определите
квантованные значения проекции момента импульса
на ось z.