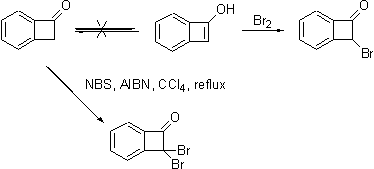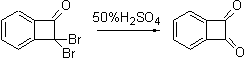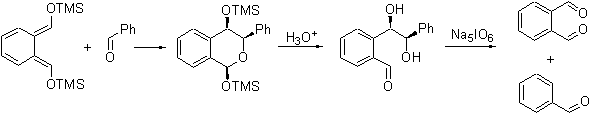Интернет-олимпиада по химии
Органическая химия
Три изомерных углеводорода A, B, C
проявляют свойства диенов в реакции Дильса-Альдера. При этом, А – активнейший диен, реагирующий
практически с любыми диенофилами (вследствие этого A весьма
неустойчив и подвергается быстрой и необратимой димеризации даже при низких
температурах с образованием димера A2). При облучении ультрафиолетом (длина волны
>300 нм) A
переходит в B.
B охотно
реагирует с многими диенофилами только при нагревании до 200°С. При
высокотемпературном флэш-пиролизе B образуется
С.
Углеводород С
реагирует только с достаточно активными диенофилами, например, с п-бензохиноном
при кипячении в ксилоле, образуя ярко-желтый продукт CQA.
Все три углеводорода и их многочисленные производные
находят широкое применение в химии и технологии полимеров. Особенно интересен в
этом отношении B – как
его гомополимер, так и сополимеры с участием фрагментов B обладают рядом уникальных
свойств, обусловливающих их применение в различных областях, например,
микроэлектронике, медицине, технологии полимерных композиций, отверждающихся
при высокой температуре, и т.п. Аддукт B и
фуллерена C60 используется для получения сополимеров,
содержащих фуллереновые фрагменты.
Одно из простых производных B
(соединение BK) легко
получается при действии амида натрия в жидком аммиаке на смесь бромбензола и
диэтилацеталя кетена с последующей обработкой продукта реакции разбавленной
водной кислотой. Реакция BK с 2
экв. NBS в
присутствии перекиси бензоила в CCl4 дает
дибромид BKBr2,
который при обработке 50%-ной серной кислотой переходит в соединение BDK. Действие водной щелочи на BDK с последующим подкислением
дает хорошо известный продукт, 3-гидроксифталид, с количественным выходом.
Фотолиз BDK (УФ l = 290 нм) дает
неустойчивое высокореакционноспособное соединение BBK, которое является эффективным перехватчиком монооксида азота
(реакция в сухом бензоле дает N-гидроксифталимид, хорошо известный инициатор
радикальных реакций), а в присутствии п-хинонов дает производные хинизарина.
Восстановление BDK борогидридом натрия
с последующей обработкой продукта восстановления триметилхлорсиланом дает
продукт BDH-TMS,
бесцветный ниже 0°С, желтый при комнатной температуре, причем желтая окраска
немедленно пропадает при добавлении олефинов или других непредельных
соединений. BDH-TMS
представляет собой рацемическую смесь, которую невозможно расщепить на
энантиомеры из-за очень быстрой рацемизации. Это соединение легко реагирует с
бензальдегидом c образованием соединения BDHA,
которое легко гидролизуется водными растворами кислоты с образованием
вицинального трео-диолаthreo-DH.
Последний расщепляется периодатом натрия с образованием эквимольной смеси
бензальдегида и фталевого диальдегида.
Соединение BK
реагирует c литийорганическим производным углеводорода C с образованием продукта BKA, который при восстановлении по
Клемменсену дает то же соединение, что можно легко получить при реакции
Дильса-Альдера B + C.
Задания.
1.
Нарисуйте формулы упомянутых в тексте (зашифрованных
латинскими буквами жирным шрифтом) соединений. Для BDH-TMS, BDHA, threo-DHукажите
стереохимию.
2.
Напишите схемы всех упомянутых реакций.
3.
Предложите механизм рацемизации энантиомеров BDH-TMS и объясните, почему не это
соединение не теряет диастереомерную чистоту.
4.
Предложите механизмы для следующих превращений: а) синтез
BK; б)
действие щелочи на BDK;в) превращение BDH-TMSв BDHA; г)
превращение BKвBKA.
5.
Нарисуйте структурную единицу гомополимеров An, Bn и Cn. Какой
тип инициирования можно применять для полимеризации B? На
какой реакции может быть основана способность полимеров, содержащих структурные
фрагменты B,
отверждаться при нагревании?
Внимание: Решения задачи должны быть записаны с
использованием стандартных способов представления структурной и
стереохимической информации (см. любой рецензируемый журнал по органической
химии) корректными, не допускающими двусмысленного толкования формулами.
Двусмысленность решения не будет
толковаться в пользу соискателя, неясные решения (например, использование
некорректных стереохимических формул, не позволяющих однозначно определять
положения заместителей в молекуле, использование неопределенных пунктирных
линий для обозначения делокализации) будет считаться ошибкой.
Решение
Прежде чем обсуждать решение задачи, хочу заметить, что
органическая химия – наука не абстрактная, и органические тексты следует
понимать буквально. Если написано, что нечто является простым производным B, а B – это
углеводород, то так оно и есть. Начнем, следовательно, с реакции бромбензола с
диэтоксиэтеном в присутствии сильного основания, то есть в условиях генерации
бензина, который взаимодействует с олефинами по механизму согласованного
[2+2]-присоединения, образуя четырехчленный цикл. После гидролиза имеем
бензоциклобутенон.

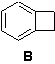
Бензоциклобутенон является простым производным (кетоном)
углеводорода бензоциклобутена (он же циклобутабензол, он же бицикло[4.2.0]окта-1,3,5-триен)
B:
Это
соединение и его аналоги (циклобутарены) – весьма интересные и популярные
объекты исследования в органическом синтезе. Несмотря на очевидное сильное
напряжение молекулы, эти соединения, как правило, вполне устойчивы и не требуют
каких-либо специальных приемов и условий для работы и хранения. Важнейшим их
свойством является обратимая изомеризация (термическая или фотохимическая) в
орто-хинодиметаны.
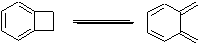
Хинодиметан
– высокореакционноспособный диен, который можно спектрально обнаружить при
низких температурах, и который, за неимением других партнеров, ест сам себя с
образованием димеров и олигомеров даже при –150°С. Есть два типа димеров, один
из них образуется по Дильсу-Альдеру, другой в [4+4]-процессе.
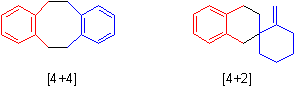
С любыми
диенофилами хинодиметан реагирует по Дильсу-Альдеру с использованием только
экзоциклических двойных связей, так как при этом достигается огромный выигрыш
энергии за счет реставрации ароматичности в нововыявленном бензольном кольце.
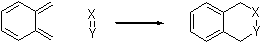
Очевидно,
что хинодиметан является достойным кандидатом на место углеводорода A.
Третий
изомер найти несколько сложнее. Очевидно, что брутто-формула - C8H8. Может быть диеном, но без
особого удовольствия, и только, если сильно попросят. Популярен в полимерной
химии. Образуется при флэш-пиролизе бензоциклобутена. Последняя зацепка очень
важна – очевидно, что в этом соединении две уязвимые для гомолитического
разрыва связи в циклобутановом кольце.
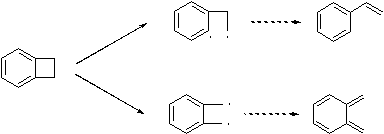
Второй
путь ведет к хинодиметану, и следовательно неинтересен. Первый же ведет к
стиролу. Стирол(ы) широко применяются в полимерной химии. Но диеном стирол
отважится назвать не каждый. И напрасно. Применение виниларенов и самого
стирола в химии Дильса-Альдера известно достаточно хорошо (см. например, TetrahedronLett.,
1997, 3047 и ссылки в этой работе). Большинство таких реакций требует
применения интенсивных способов стимулирования диенового синтеза (катализаторов
кислот Льюиса, высоких давлений), но с активными диенофилами, даже такими
тривиальными как бензохинон, стирол реагирует просто при нагревании, то есть
ненамного хуже, чем такие патентованные диены как бутадиен и изопрен. Чтобы
понять, что при этом получается, опять следует внимательно и с полным доверием
читать текст задачи – « вещество ярко-желтого цвета ». Не просто желтого или
желтоватого, а – ярко-желтого. Цвета хинона, иными словами. Ничего
удивительного здесь нет. Хорошо известно, что первичные продукты реакции
Дильса-Альдера с диенофилами часто подвергаются быстрому окислению
бензохиноном. Избежать этого часто невозможно, так как сама реакция Д-А
довольно медленна, а окисление проходит быстро, особенно, если это кому-нибудь
выгодно (например, что-нибудь ароматизуется). Так и здесь. Очевидно, что ни
явно неустойчивый первичный продукт реакции, ни оба возможных продукта его
изомеризации – ненасыщенный кетон и гидрохинон - не могут претендовать на
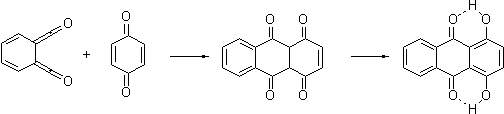
сколько-нибудь заметную цветность, а тем более на яркую(!) желтизну. А вот
продукт окислительной ароматизации, 1,4-фенантренхинон, должен быть желт или
оранжев, как и положено всем приличным 1,4-хинонам.
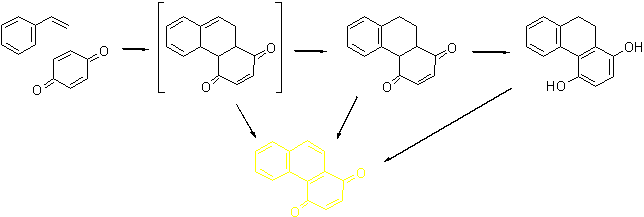
Действительно,
реакция стирола и бензохинона представляет собой простой и удобный метод
одностадийного синтеза этого хинона. Выход невелик (около 30%), но исходные
дешевы и доступны бочками.
Все
дальнейшее просто.
Бензоциклобутенон
бромируется с радикальным инициатором, а не просто так, как все нормальные
кетоны, так как его енол имеет структуру бензоциклобутадиена, что нельзя
назвать везением.
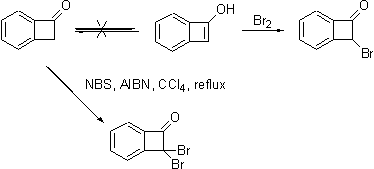
Гидролиз
гем-дигалогенциклобутанов крепкими кислотами в соответствующие кетоны весьма
характерен для циклобутановой химии.
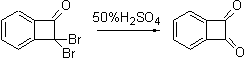
Бензоциклобутендион также весьма интересен и богат
нетривиальной химией. Его изомеризация дает бис-кетен – производное
хинодиметана, также весьма реакционноспособный

Для BBK можно написать
альтернативную структуру фталидного карбена

Скорее
всего, эти структуры находятся в быстром равновесии. Для ответа годится любая.
С NO
происходит согласованная хелотропная реакция внедрения с образованием радикала,
выхватывающего водород из растворителя.
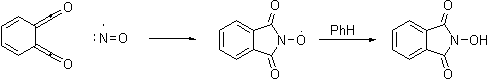
С хиноном происходит реакция Дильса-Альдера. Продукт
изомеризуется в хинизарин (1,4-дигидроксиантрахинон). Так как в этом случае
реакция очень быстрая, продукт не окисляется бензохиноном.
Реакция
бензоциклобутендиона со щелочью – типичное расщепление карбонильного соединения
основанием по типу галоформной реакции. Здесь следует попенять любителям
изображать механизмы произвольными комбинациями кривых стрелочек, изображающих
причудливые перемещения электронов и атомов в направлении, заданном ожидаемым
результатом. Это не есть механизм реакции (если, конечно, речь не идет об
одностадийной согласованной реакции). Механизм должен отвечать на вопрос,
почему это происходит, а следовательно оперировать достоверными или
правдоподобными аналогиями, и показывать возможные разумные интермедиаты.
В данном
случае вероятно образование тетраэдрического аддукта и расщепление С-С связи с
последующим протонированием карбаниона.

После
подкисления образуется альдегидофталевая кислота, более известная по названию
своего более устойчивого кольчато-цепного таутомера как оксифталид. Вниманию
большинства – ФТАЛИД – это не фталимид и не
фталевый ангидрид, а лактон о-гидроксибензойной кислоты, что можно найти в
справочнике или учебнике - никто ведь не мешал.
Дикетон
восстанавливается борогидридом в диол, диол дает силиловый эфир BDH-TMS. Раз он назван рацематом,
значит это транс-форма. Интересной особенностью бензоциклобутенов является то,
что изомеризация в хинодиметан облегчается донорными заместителями, так что
диалкоксипроизводное изомеризуется при комнатной температуре, чем и обусловлен
термохромизм (обратимое изменение цвета при изменении температуры). Раскрытие
циклобутенового кольца в бутадиен и обратная реакция – процессы согласованные,
стереоспецифичные. По правилам Вудварда-Хофмана термический процесс должен
происходить конротаторно (вращение в одну сторону), т.е. стереохимия бутадиена
(здесь, хинодиметана) – цис,цис (маловероятно по стерическим причинам), или
транс,транс, но не цис,транс.
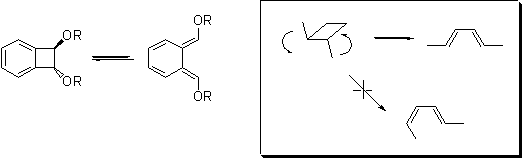
Хинодиметан
– плоский. Отсюда рацемизация. Обратный процесс столь же стереоспецифичен.
Отсюда – сохранение диастереоизомерной чистоты, то есть отсутствие изомеризации
транс-цис даже в малой степени. И стерика здесь ни при чем.
Диалкоксихинодиметан,
как его предок, очень жадный диен, но все же несколько менее
реакционноспособный, чем A, и хотя бы сам с собой не реагирует. Зато он реагирует
со всеми диенофилами, в том числе гетеродиенофилами, с образованием аддуктов.
Стереохимию аддукта с бензальдегидом нельзя установить из общих cоображений, но
можно установить из приведенной химии по трео-конфигурации диола.
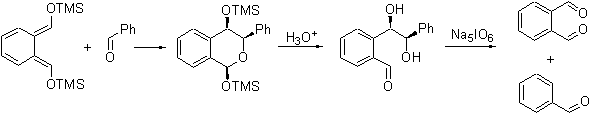
Итак – конфигурация аддукта – все вверх (или все вниз).
Реакция
бензоциклобутенона с литийорганическим производным стирола имеет два решения, так
как годится и a- и b-литированный стирол. Смысл
происходящего - в реакции карбаниона с карбонильной группой. Аддукт
представляет собой бензоциклобутен с сильнейшим донорным заместителем, он, как
уже было сказано, легко изомеризуется в соответствующий хинодиметан, который
претерпевает согласованную гексатриен-циклогексадиеновую изомеризацию. Можно
предложить и равновероятный механизм, включающий карбанион винилога
орто-метилбензофенона (в рамочке). Такую же схему можно написать и с a-литированным
стиролом.
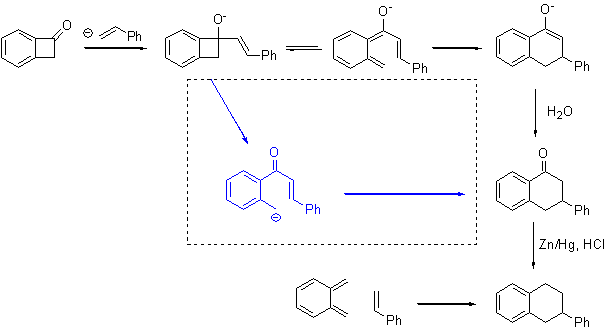
Вот и вся химия.
Зная
структуры мономеров, написать полимеры несложно. Очевидно, что Anи
Bn – одно и то же. Более того, очевидно, что полимеризация
бензоциклобутена должна происходить через хинодиметан, то есть через термическое
+ радикальное инициирование. Просто радикальное ничего, кроме радикала
бензоциклобутена не даст. Вместо радикального можно представить себе и
катионное, и анионное инициирование, так как соответствующие частицы разумны.
Стирол полимеризуется любым способом.
Полимеры,
имеющие в своем составе звенья бензоциклобутана имеют интересное свойство
стекловаться при нагревании, что должно быть связано с генерацией хинодиметана
и его сшивкой с любыми фрагментами, содержащими кратные связи.
Химия
циклобутаренов и хинодиметанов описана во множестве книг и обзоров, из которых
свежайший A. K.
Sadana, R.
K. Saini,
W. E.
Billups, CyclobutarenesandRelatedCompounds, Chem.
Rev. 2003, 103, 1539-1602.
Полимерная
химия циклобутаренов и хинодиметанов описана, например, в обзоре FaronaM.F.
Progress. Polym.
Sci., 1996, 505.
Общее
число баллов за задачу – 43 (что соответствует 100 в итоговом протоколе).
Подсчет баллов совершенно формальный – по количеству верных структур и реакций,
соответствующих заданным вопросам. За оригинальные идеи можно было получить
бонусные очки, но таковых (идей, очков) не обнаружено. Составитель задачи не
был уверен в отсутствии у нее альтернативных решений, удовлетворяющих всем
условиям. Но таковых также предложено не было. Следовательно, у этой задачи и
нет альтернативного решения.
Андрей
Владимирович Чепраков,
доцент
кафедры органической химии
Химического факультета МГУ
avchep@elorg.chem.msu.ru