LXI Московская городская олимпиада школьников по химии
11-1. Определите брутто-формулу углеводорода, который имеет плотность по водороду меньше 75 и содержит 87,27% углерода по массе. Предложите строение этого углеводорода, если известно, что он имеет в своей структуре только вторичные и третичные атомы углерода и как минимум два шестичленных цикла. Сколько различных монохлорпроизводных образуется при его неселективном радикальном хлорировании на свету?
11-2.
Определите сколько тепла выделится
при образовании 1 моль бромоводорода по реакции:
H2(газ) + Br2(раствор)
= 2HBr(раствор),
если известно, что:
2KBr(раствор)
+ Cl2(газ) = 2KCl(раствор)
+ Br2(раствор)
+ 92,9 кДж
b) H2(газ) + Cl2(газ) = 2HCl(раствор) + 333,6 кДж
c) KOH(раствор) + HCl(раствор) = KCl(раствор) + H2O + 55,8 кДж
d) KOH(раствор) + HBr(раствор) = KBr(раствор) + H2O + 55,8 кДж
Все данные приведены для реакций при одинаковой температуре и давлении.
Объясните, почему в реакциях с) и d) выделяется
одинаковое количество тепла.
11-3. В вашем распоряжении имеются три монеты – железная, медная и золотая; водный раствор FeCl3, кварцевые стаканы и дистиллированная вода. Кратко опишите последовательность действий позволяющих покрыть железную и золотую монету слоем меди. Приведите уравнения реакций.
11-4. В ходе вьетнамской войны американская армия применяла гербицид 2,4,5-T, который вызывал опадение листьев в джунглях. Вещество 2,4,5-T синтезировали из основного продукта реакции бензола с избытком хлора в присутствии FeCl3 – вещества X. Обработка X гидроксидом натрия при 150 °С приводит к веществу Y состава С6H2Cl3NaO. Однако, как было обнаружено позднее, эта реакция дает еще и соединение Z состава С12H4Cl4O2. Примесь Z в гербициде привела впоследствии к массовой гибели солдат американской армии от рака. Приведите структурные формулы веществ X, Y, Z. Предложите структуру гербицида 2,4,5-Т, если известно, что он получается при реакции Y c хлоруксусной кислотой.Расшифруйте аббревиатуру 2,4,5-Т и приведите тривиальное название вещества Z.
11-5. При нагревании 1,000 грамма некоторой соли образуется три оксида: твердый (0,878 г), жидкий (0,0354 г) и газообразный (0,0866 г) (агрегатное состояние приведено для 25°С и 1 атм). С помощью расчетов определите формулу соли и напишите реакцию ее разложения.
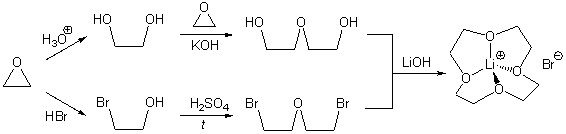
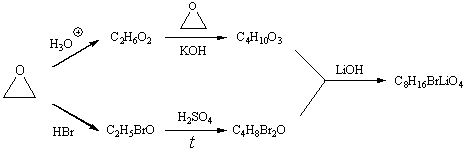
11-6.Расшифруйте цепочку превращений (приведите структурные формулы конечного продукта и промежуточных веществ). Изобразите возможное пространственное строение конечного продукта синтеза (C8H16BrLiO4). Предложите метод превращения C8H16BrLiO4 в соединение C8H16O4, которое обладает таким же углеродным скелетом.
 |
11-1.
Определим молярную массу искомого углеводорода: n*12,01/0,8727 = n*13,75,
где n = число атомов углерода, что
соответствует простейшей формуле C4H7. При
условии, что плотность паров вещества по водороду меньше 75, единственной
подходящей брутто-формулой является C8H14. Для
того, чтобы получить структурную формулу углеводорода с таким составом,
содержащим два шестичленных цикла, невозможно ограничиться рассмотрением
плоских структур. Решением задачи является 2,2,2-бициклооктан (см. рис).
При неселективном радикальном хлорировании на свету он образует два
изомерных монохлорпроизводных одно из которых может существовать в виде
двух энантиомеров.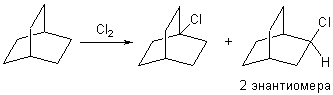
11-2.
Согласно закону Гесса тепловой эффект реакции может
быть представлен в виде суммы нескольких тепловых эффектов. В данном
случае при суммировании уравнений следующим образом "−2d+2c+b−a"
получается искомая реакция:
H2(газ) + Br2(раствор) = 2HBr(раствор) и ее
тепловой эффект 240,7 кДж
На один моль HBr тепловой
эффект составляет 120,4 кДж. В реакциях с) и d)
выделяется одинаковое количество тепла, так как они имеют одинаковое
сокращенное ионное уравнение: H+ + OH− = H2O.
11-3.
Для переведения меди в раствор следует воспользоваться
реакцией: FeCl3 + Cu = FeCl2 + CuCl2. Дальнейшее опускание в этот раствор
железной монеты приводит к вытеснению меди из CuCl2 (согласно ряду активности металлов) и
осаждению ее на монете по уравнению: Fe + CuCl2 = FeCl2 + Cu. Для того, чтобы покрыть медью золотую
монету необходимо опустить ее в раствор вместе с железной так, чтобы они
касались ребром. При этом образуется гальванический элемент Au/Fe и железо
окисляясь переходит в раствор, а медь восстанавливаясь осаждается на
золоте.
11-4.
Исходя из состава и метода получения логично
предположить, что вещество Y является трихлорзамещенным фенолятом
натрия. Положения атомов хлора 2,4,5 определяются либо по названию 2,4,5-T, либо по
строению вещества X, которое очевидно является
тетрахлорбензолом. При последовательном хлорировании бензола, согласно
правилам ароматического замещения должен преимущественно образовываться
1,2,4,5-изомер. Состав вещества Z указывает
на наличие в нем двух бензольных колец, в каждом из которых находится 2
хлорных заместителя. Легко заметить, что состав Z можно
получить при удвоении состава Y и вычитании 2 NaCl,
исходя из чего строится структурная формула Z.
Тривиальное название этого вещества - диоксин, один из сильнейших ядов и
канцерогенов. Структурная формула 2,4,5-T
получается замещением атома хлора в хлоруксусной кислоте на радикал Y.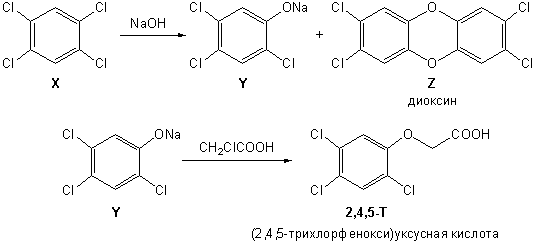
11-5.
Наиболее вероятным жидким оксидом является вода. Исходя
из этого определим молярную массу газообразного оксида: 0,0866/(0,0354/18)
= 44. Наиболее вероятный оксид с такой массой - CO2. Тогда первоначальная соль является
основным карбонатом тяжелого металла, разлагающимся по уравнению: (MOH)2CO3 = 2MO
+ H2O + CO2 (для двухвалентного металла). Определим
молярную массу оксида металла: 0,878/(0,0354/18) = 446,4*n. В случае двухвалентного металла n (соотношение между коэффициентами перед
водой и оксидом металла в уравнении разложения соли) составляет 0,5.
Получаем молярную массу оксида металла 223,2, которая соответствует PbO. Ответ:
(PbOH)2CO3 = 2PbO + H2O + CO2
11-6.
Целевое вещество - соль LiBr
с 12-краун-эфиром-4. Выделить чистый краун-эфир можно с помощью
электролиза раствора или (что существенно хуже) с помощью переведения Li в
нерастворимые соли.