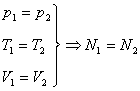|
Урок 6. Закон Авогадро. Молярный объем газа.
Новое содержание: закон Авогадро, молярный объем газа, нормальные условия (н. у.)
Методические рекомендации учителю: Закон Авогадро удобно записать в виде схемы:
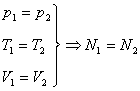
подчеркивая тем самым, что число молекул в равных объемах различных газов одинаково лишь при условии, что эти газы имеют равные температуры и давления.
Молярный объем целесообразно вводить по аналогии с молярной массой, подчеркнув, что он представляет собой объем, занимаемый газом в количестве вещества один моль. Необходимо различать нормальные (1 атм, 0°C) и стандартные (1 атм, 25°C) условия. Строго говоря, величина 22,4 л представляет собой молярный объем идеального газа при н.у. Молярные объемы реальных газов в той или иной степени отклоняются от нее. Их можно рассчитать, зная плотности газов. Так, например, из плотности аммиака 0.7714 г/л (н. у.) следует, что его молярный объем равен 22,04 л, т. е. отклоняется от объема идеального газа на 2%. Для сильных учащихся можно предложить задачу рассчитать молярный объем аммиака, исходя из его плотности.
Следует также разобрать задачу на расчет объема газа (н. у.) по известной его массе.
Планируемые результаты обучения: уметь рассчитывать количество вещества газа и число молекул исходя из объема газа при н. у.
Тема краткой проверочной работы: расчет по уравнению реакции
Демонстрации: Модель молярного объема газа
Задание: §6
|