УДК 541.183:543.422
ГИДРОКСИЛЬНЫЙ ПОКРОВ И ЭЛЕКТРОНОАКЦЕПТОРНЫЕ
СВОЙСТВА ПОВЕРХНОСТИ ДИОКСИДА ЦИРКОНИЯ,
ПРОМОТИРОВАННОГО КАТИОНАМИ СТРОНЦИЯ, БАРИЯ И
КАЛЬЦИЯ
А.Н. Харланов, Н.А. Зубарева, Е.В. Лунина, В.В.
Лунин, В.А. Садыков, А.С. Иванова
(кафедра физической
химии)
Методами ИК- и ЭПР-спектроскопии адсорбированных молекул-зондов
проведен анализ кислотно-основных свойств
поверхности диоксида циркония, промотированного
катионами стронция, кальция и бария. Показано,
что введение катионов стронция приводит к
уменьшению концентрации терминальных
гидроксильных групп. Это находит свое отражение
в снижении концентрации льюисовских кислотных
центров с ростом концентрации стронция без
изменения их электроноакцепторной способности. Промотирование
диоксида циркония катионами кальция
способствует повышению электроноакцепторной способности
ЛКЦ. Изучены формы адсорбции NO на поверхности
окисленных и частично восстановленных
стронциево-циркониевых систем.
Промотирование оксида
циркония позволяет существенно улучшить его
механические свойства и термическую
стабильность. Однако свойства поверхности при
этом могут значительно измениться.
Известно, что в
каталитических превращениях существенную роль
играют функциональные группы поверхности
катализатора (ОН-группы) и электроноакцепторные
центры. Изучение адсорбции простых молекул
методом ИК-спектроскопии может дать весьма
ценную информацию о природе активных центров подобных систем. В
данной работе методом ИК-спектроскопии изучены
физико-химические свойства диоксида циркония,
промотированного оксидами стронция кальция и
бария. Рассмотрено влияние промотирования на
структуру гидроксильного покрова и
электроноакцепторные свойства поверхности,
изучена адсорбция оксида азота (II). Основное
внимание уделено наиболее перспективным
стронциево-циркониевым системам.
Экспериментальная часть
Образцы кальциево-, бариево- и
стронциево-циркониевых катализаторов были
получены по методу соосаждения гидроксидов
водным раствором аммиака из раствора нитратов
соответствующих элементов, взятых в заданном
соотношении. Полученный продукт подвергали
сушке с последующим прокаливанием при 700o. Характеристики
полученных образцов (содержание промотора,
величина удельной поверхности и кристаллическая
модификация ZrO2) приведены в табл. 1.
Перед адсорбцией СО и NO
катализаторы подвергали двум типам обработки. В
первом случае образцы были получены путем
прогревания в атмосфере осушенного кислорода
при температуре 400o в течение 0,5 ч с последующим
охлаждением до комнатной температуры и откачкой
при этой температуре до 10-5
мм рт. ст. Такие образцы могли
содержать хемосорбированный кислород. Во втором
случае образцы были получены прокаливанием в
течение 2 ч на воздухе с последующим
вакуумированием при 500o также в
течение 2 ч.
Газообразный СО подвергали
очистке, пропуская
через ловушку с жидким азотом и долго выдерживая
над прокаленным цеолитом. Адсорбцию СО и NO
проводили при комнатной температуре и давлении
адсорбата 0,5-20 мм рт. ст. (СО) и 10-60 мм рт. ст. (NO).
Десорбцию NO проводили вакуумированием при
комнатной температуре, а также при 100, 200, 300, и 400o.
Электроноакцепторные
свойства поверхности были исследованы с помощью
метода парамагнитного зонда. В качестве зонда
был использован стабильный нитроксильный
радикал 2,2,6,6-тетраметилпиперидин-1-оксил (ТЕМПО).
Адсорбцию ТЕМПО проводили из паров в
адсорбционно-вакуумной установке, дозировку
осуществляли объемным методом.
ИК-спектры диффузного отражения
регистрировали на спектрофотометре "Specord-M-80". Порошкообразную
фракцию оксида (0,25-0,5 мм) помещали в кварцевую ампулу с
окошком из CaF2.
ИК-спектры адсорбированного NO
были сняты на спектрофотометре "UR-20", образцы для этих измерений
предварительно прессовали в таблетки. Спектры
ЭПР регистрировали на радиоспектрометре
отражательного типа в Х-диапазоне.
Удельную поверхность образцов определяли
хроматографически по низкотемпературной
адсорбции азота. Данные рентгенофазового
анализа (РФА) были получены на дифрактометре "ДРОН-2"
с Cu-K -излучением.
Концентрацию тетрагональной фазы в ZrO2, представляющей
собой смесь
моноклинной и тетрагональной модификаций
определяли по методике [2] путем сравнения
величин относительной интенсивности пиков
моноклинной (2 -излучением.
Концентрацию тетрагональной фазы в ZrO2, представляющей
собой смесь
моноклинной и тетрагональной модификаций
определяли по методике [2] путем сравнения
величин относительной интенсивности пиков
моноклинной (2 1
= 28,30o - плоскость (111);
2 1
= 28,30o - плоскость (111);
2 2 = 31,55o -
плоскость (111); Cu-K 2 = 31,55o -
плоскость (111); Cu-K -излучение, -излучение,
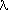 = 1,5405 A )
и тетрагональной ( 2 = 1,5405 A )
и тетрагональной ( 2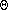 = 30,55o.
плоскость (111)) фаз по формуле = 30,55o.
плоскость (111)) фаз по формуле
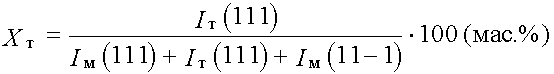
где Iм и Iт -
интенсивности дифракционных максимумов от
соответствующих плоскостей моноклинной и
тетрагональной фаз. Точность определения
концентрации тетрагонального ZrO2,
согласно данным [2], составляет 3
мас.%.
Обсуждение результатов
Данные, приведенные в табл. 1,
показывают, что введение щелочноземельных
металлов (Ba, Ca, Sr) в кристаллическую структуру
диоксида циркония позволяет получить системы с
высокоразвитой поверхностью, а введение Sr - стабилизировать
кубическую модификацию ZrO2,
обладающую лучшими
механическими свойствами, чем характерная для
чистого ZrO2 моноклинная. ИК-спектры ОН-групп
образцов, содержащих SrO в качестве модифицирующей добавки,
образованы суперпозицией двух групп
перекрывающихся полос поглощения (п.п.) (рис.1, б,
в), которые, в соответствии
с современными представлениями о строении
гидроксильного покрова оксида [3], соответствуют
гидроксильным группам, различающимся
координационным числом: терминальным типа I (п.п.
3770 и 3790 см-1), двухкоординированным мостиковым
типа II (п.п. 3738 см-1 ) и трехкоординированным мостиковым
типа III ( п.п. ~3665 и 3690 см-1).
В соответствии с [4], данные полосы
поглощения могут быть отнесены к гидроксильным
группам собственно ZrO2, преимущественно на участках
поверхности со структурой граней (111) и (110)
флюоритоподобной модификации ZrO2
Введение стронция в ZrO2 не изменяет
набора поверхностных гидроксильных групп, при
этом не наблюдаются п.п. терминальных гидроксильных групп,
локализованных на катионах стронция. Возможно,
что в координационной сфере катионов
двухвалентного стронция, изоморфно замещающих
катионы четырехвалентного циркония в решетке ZrO2, терминальные
ОН-группы отсутствуют.
Хорошо прослеживается, что относительный вклад
в спектр п.п. терминальных гидроксильных групп,
локализованных на катионах Zr, с увеличением концентрации Sr понижается (рис. 1, б,
в). Можно предположить, что
данное изменение является следствием замещения
катионами Sr2+ части катионов Zr4+ на поверхности.
Адсорбция СО на поверхности
стронциево-циркониевых образцов сопровождается
появлением двух перекрывающихся п.п. (рис.2, б - г),
частоты которых (2188 и 2200 см-1), согласно
данным работ [5, 6], соответствуют комплексам СО с
двумя типами льюисовских кислотных центров (ЛКЦ) - координационно ненасыщенными (КН)
катионами Zr4+.
Электроноакцепторная
способность наиболее сильных ЛКЦ
характеризуется частотой колебания связи С-О в карбонильном комплексе
 CO=2200 см-1, что сравнимо с электроноакцепторной
способностью ЛКЦ на поверхности чистого ZrO2 моноклинной
модификации [6, 7]. Отметим, что влияние
промотирующего компонента проявляется в
изменении соотношения между концентрациями двух
типов ЛКЦ в сторону увеличения вклада наиболее
сильных ( CO=2200 см-1, что сравнимо с электроноакцепторной
способностью ЛКЦ на поверхности чистого ZrO2 моноклинной
модификации [6, 7]. Отметим, что влияние
промотирующего компонента проявляется в
изменении соотношения между концентрациями двух
типов ЛКЦ в сторону увеличения вклада наиболее
сильных ( CO=2200
см-1) ЛКЦ. Предполагается, что данный тип
ЛКЦ образуется при удалении терминальных
гидроксильных групп, поэтому можно ожидать
понижения концентрации ЛКЦ при увеличении
содержания Sr. Данные
ИК-спектроскопии СО подтверждают это
предположение (рис.2, б, в). CO=2200
см-1) ЛКЦ. Предполагается, что данный тип
ЛКЦ образуется при удалении терминальных
гидроксильных групп, поэтому можно ожидать
понижения концентрации ЛКЦ при увеличении
содержания Sr. Данные
ИК-спектроскопии СО подтверждают это
предположение (рис.2, б, в).
ИК-спектр гидроксильного
покрова образца, содержащего 5 мол.% CaO, также образован
преимущественно суперпозицией п.п., характерных
для гидроксильных групп поверхности ZrO2 (рис. 1, д).
Увеличение вклада в спектр
гидроксильного покрова полосы поглощения с
частотой 3660 см-1 указывает на изменение структуры
поверхности ZrO2 под влиянием промотирования
кальцием. Повышение интенсивности п.п. 3660 см-1, в
соответствии с [4], указывает на увеличение вклада
участков поверхности со структурой грани (111)
тетрагонального ZrO2.
Иная картина наблюдается при
введении в решетку ZrO2 катионов бария. Хотя ИК-спектр гидроксильного
покрова бариево-циркониевой системы и образован
преимущественно п.п. ОН-групп ZrO2,
в отличие от кальций- и
стронциево-циркониевой систем существенный вклад
вносит новая, не характерная для ОН-групп ZrO2, п.п.
при 3750 см-1
(рис.1, г). Возможно,
что наличие этой п.п. отражает присутствие на
поверхности ОН-групп, локализованных на катионах
бария.
Адсорбия СО на
поверхности бариево- и кальциево-циркониевых
систем также сопровождается появлением п.п.
карбонильных комплексов с КН-катионами Zr4+
(рис.2, г, д). Следует
заметить, что частота ИК-поглощения СО,
адсорбированного на поверхности
бариево-циркониевого образца на 5 см-1 выше, чем
адсорбированного на чистом ZrO2.
Это указывает на некоторое
повышение электроноакцепторной способности ЛКЦ
при модифицировании ZrO2 барием.
Адсорбция ТЕМПО на
поверхности ZrO2 и бинарных систем на его основе сопровождается
появлением в спектре ЭПР анизотропного
триплетного спектра. Константа анизотропного
СТВ неспаренного электрона с ядром 14N (A||)
чувствительна к
электроноакцепторной способности центров [8].
Спектр ЭПР нитроксильного радикала ТЕМПО,
адсорбированного на поверхности
стронцийсодержащего образца (5% SrO) представляет
собой анизотропный триплет с параметром A|| = 42,1 Гс (табл. 2). Подобное значение A|| характерно для
взаимодействия ТЕМПО с КН-катионами циркония. С
увеличением концентрации стронция
электроноакцепторная способность ЛКЦ
понижается до значений A|| = 39,7 Гс. Увеличение значения A||
наблюдается также для
кальциево-циркониевого образца. Этот результат
находится в противоречии с данными
ИК-спектроскопии СО, согласно которым
электроноакцепторная способность центров при
введении Ca2+ не увеличивается. Возможно, в данном
случае высокая чувствительность метода
парамагнитного зонда позволяет обнаружить малые
количества наиболее сильных центров, не
регистрируемых методом ИК-спектроскопии.
Адсорбция NO на чистом ZrO2 была изучена в
[9]. При адсорбции NO на чистом оксиде циркония в
спектре наблюдали п.п. 2260 и 2250 см-1,
которые были отнесены к NO+, и п.п. в области 2000-1800 см-1, обусловленные
взаимодействием NO с ЛКЦ.
На модифицированных стронцием (5% SrO) образцах
отсутствуют п.п., соответствующие каким-либо
формам адсорбированного NO (рис.3, а,б, спектр 2). Адсорбция NO на окисленном образце
приводит к появлению п.п. нитратных комплексов 1630
и 1610 см-1 только
после 15-ти часовой экспозиции образца в
атмосфере NO (спектр 3). Эти п.п. исчезают в процессе
вакуумирования при комнатной температуре
(спектр 4). В
спектре частично восстановленного
стронциево-циркониевого образца (рис. 3, б, спектры 2,3) после напуска NO наблюдается только
малоинтенсивная п.п. 1240 см-1,
которая может быть обусловлена
валентными колебаниями необратимо
адсорбированного NO [10, 11].
Если в системе присутствуют следы кислорода, то
отмечается появление п.п. нитратных комплексов с
частотами 1600 и 1630 см-1 (рис. 3, а, спектр
5; рис. 3, б,
спектры 4,5).
При этом образующиеся нитратные
формы настолько слабо связаны с поверхностью,
что их удаление происходит уже после
вакуумирования при комнатной температуре.
Десорбция нитратных комплексов с поверхности
диоксида циркония происходит после
вакуумирования при 350o [9].
Таким образом, введение
катионов стронция снижает электроноакцепторные
свойства поверхности, а также способность
удерживать оксид азота (II) в
координационносвязанном или окисленном
состоянии, что обусловливает формирование
достаточно инертной поверхности. Введение бария
наоборот повышает электроноакцепторную
способность поверхности.
Представленные в работе результаты наглядно
демонстрируют возможность варьировать свойства
поверхности в широких пределах, что представляет
значительный интерес .
Данная работа выполнена при финансовой
поддержке Российского фонда фундаментальных
исследований РАН (код проекта 95-03-08196а).
Т а б л и ц а 1
Характеристики образцов модифицированного ZrO2
| Образец |
Содержание
модификатора, ат.% |
Sуд, м /г2 |
Фазовый состав |
| ZrO |
- |
12 |
M + T* |
| Sr-Zr-O |
5 |
90 |
K + M (1:1) |
| Sr-Zr-O |
10 |
100 |
K + M* |
| Ba-Zr-O |
5 |
100 |
T + M (2:1) |
| Ca-Zr-O |
5 |
50 |
T + M (3:1) |
Примечание. М, Т, К -
моноклинная, тетрагональная и кубическая
модификации ZrO2 соответственно. Символ * означает
присутствие данной фазы в следовых количествах.
Т а б л и ц а 2
Величина константы СТВ адсорбированного ТЕМПО
Образец |
SiO2 |
ZrO2 |
Sr-Zr-O |
Sr-Zr-O |
Ca-Zr-O |
Ba-Zr-O |
С, мол.% |
- |
- |
5 |
10 |
5 |
5 |
AN|| ± 0,1 Гс |
38 |
42 |
42,1 |
39,7 |
43,5 |
43,6 |
*Содержание промотора.
Список литературы
1. Kubelka P.J. // J. Opt. Soc. Amer. 1948. 38. P. 448.
2. Whitney E.D. // J. Chem. Soc., Faraday Trans. 1965.61. P. 1991.
3. Цыганенко А.А., Филимонов В.Н. // Успехи фотоники. 1974. № 4. С. 51.
4. Morterra C., Cerrato G., Ferroni L. // Mater. Chem. Phys. 1994. 37. P. 243.
5. Morterra C., Aschieri R., Bolis V., Fubini B., Volante M. // Gazz.Chim.Ital. 1988.118. P. 479.
6. Morterra C., Aschieri R., Volante M. // Mater.Chem.Phys.1988. 20. P.539.
7. Харланов А.Н., Лунина Е.В., Лунин В.В. // ЖФХ. 1994. 68. С. 692.
8. Голубев В.Б., Лунина Е.В., Селивановский А.К. // Усп. Хим.1981. 50. С. 792.
9.Поздняков Д.В, Филимонов В.Н.// Кинет.и кат. 1973. 14. С.760.
10.Niwa M.,Furukawa Y., Murakami Y. // J. Coll. Zuterf. Sc. 1982. 86. P. 260.
11. Zaki M.J., M.Mussein J.A., Mansour S.A.A.,.El-Ammatty H.A // J.Mol.Cat. 1989. 51. P.209.
Поступила в редакцию 30. 05. 96
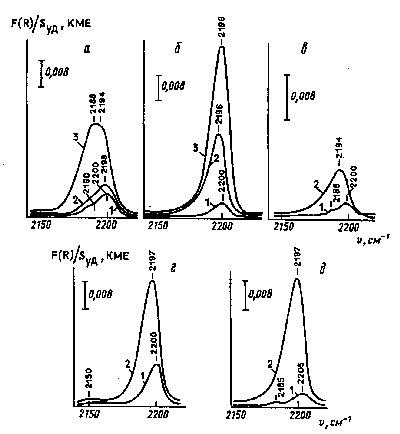 |
Рис.1. ИК-спектры гидроксильных групп:
а - чистого ZrO2;
б - Sr-Zr (0,5 % SrO);
в - Sr-Zr (10 % SrO);
г - Ba-Zr-O;
д - образца Ca-Zr-O
после термовакуумной обработки
|
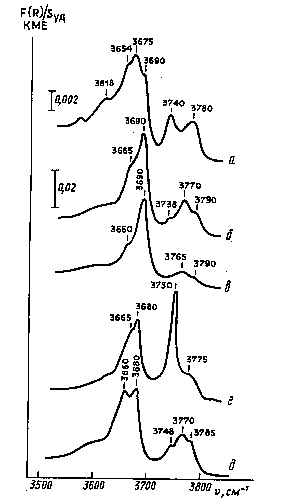 |
Рис.2 ИК-спектры СО, адсорбированного
при комнатной температуре на поверхности:
а - ZrO2;
б - Sr-Zr-O (5 % SrO);
в - образца Sr-Zr-O (10 % SrO);
г - Ca-Zr-O;
д - Ba-Zr-O после термовакуумной обработки.
Давление адсорбата, Торр: 1 –
0,5 ; 2 - 5 ; 3 - 20
|
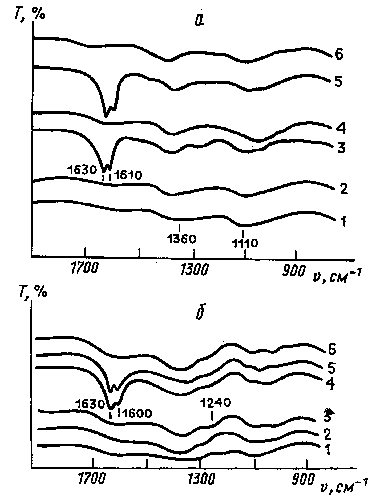 |
Рис.3 ИК-спектры образца Sr-Zr-O (5 % SrO):
а - окисленного:
1 - до напуска NO,
2 - сразу после напуска NO (18 мм рт. ст.),
3 - через 15 ч в атмосфере NO,
4 - после вакуумирования при комнатной температуре,
5 - после напуска NO и O2,
6 - после вакуумирования образца при комнатной температуре;
б - частично востановленного:
1 - до напуска NO,
2 - после напуска NO (11 мм рт. ст.),
3 - через 4 дня в атмосфере NO,
4 - после последовательного напуска NO и O2,
5 - через сутки в атмосфере NO и O2,
6 - после вакуумирования образца при комнатной температуре
|
|