Семинар 1.
1. Покажите, что в общем случае теплота не
является функцией состояния.
2. Стандартная энтальпия образования
сэндвичевого соединения бис-(бензол)-хрома была
измерена в микрокалориметре. Найдено, что
разложение 208 г соединения при 583 К
сопровождается выделением 8.0 кДж теплоты.
Продукты распада Cr(C6 H6)2 (s) –
металлический хром и газообразный бензол (Cr(s) и 2C6H6(g)).
Найдите энтальпию этой реакции и оцените
стандартную мольную энтальпию образования
сэндвичевого соединения при этой температуре. fH (C6H6 g, 583
K) = 83 кДж/моль. fH (C6H6 g, 583
K) = 83 кДж/моль.
3. Теплоемкости H2(g), O2(g) и H2O(l)
можно аппроксимировать полиномом вида
C P = a + b T + c T - 2
(значения коэффициентов приведены в таблице)
| |
а, Дж/моль К |
b , Дж/моль К2 |
c , Дж К /моль |
| H2 (g) |
27,28 |
3.26  10- 3
10- 3 |
0.5  105
105 |
| O2(g) |
29.96 |
4.18  10- 3
10- 3 |
-1.67  105
105 |
| H2O(l) |
30.54 |
10.29  10- 3
10- 3 |
0 |
Запишите формулу для расчета
(а) изменения энтальпии H2O в зависимости
от температуры и рассчитайте
[ H (H2O, l, 372.15 K) - H (H2O, l, 298.15 K],
( b ) изменения энтальпии образования воды  fHo ( H2O , l
,372.15 K), если fHo ( H2O , l
,372.15 K), если  f H o ( H2O
, l , 372.15 K) = -285.83 кДж/моль. Оцените ошибку, которая
вносится в результаты расчёта, если
предположить, что f H o ( H2O
, l , 372.15 K) = -285.83 кДж/моль. Оцените ошибку, которая
вносится в результаты расчёта, если
предположить, что  c P = 0. c P = 0.
4. Оцените поправку, которую надо внести при
расчете энтальпии реакции А + В = С из
справочных данных, если исходные и конечные
вещества находятся при давлении 108 Па.
Рассмотрите два случая: а) все вещества идеальные
газы, б) все вещества твердые.
Семинары 2-3.
1. Покажите (в общем виде), что при
кристаллизации переохлажденной жидкости
энтропия изолированной системы (вещество +
окружение) возрастает в соответствии со 2-м
законом термодинамики.
2. Функция Планка определяется как J = S –
U/T . Получите выражение для dJ и
соответствующее уравнение Максвелла.
Естественными переменными являются V и 1 / T
.
3. Покажите, как определить зависимость от
давления энтальпии, энтропии и изобарной
теплоемкости в изотермическом процессе: а) в
общем случае, б) в случае идеального газа.
4. Зависимость мольной энергии Гельмгольца
некоторой системы от температуры и объема имеет
вид:
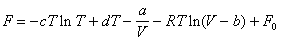 , ,
где a , b , c , d –
константы. Выведите уравнение состояния p ( V
, T ) для этой системы. Найдите зависимость
внутренней энергии от объема и температуры U (
V , T ).
5. Вычислите изменение H , U , F , G ,
S при одновременном охлаждении от 2000 К до 200 К
и расширении от 0.5 м3 до 1.35 м3 0.7 молей
азота ( CV = 5/2 R ). Энтропия газа в
исходном состоянии равна 150 Дж/(моль. К), газ можно
считать идеальным
6 . Один моль газа Ван-дер-Ваальса
изотермически расширяется от объема V 1
до объема V2 при температуре T .
Найдите  U , U ,  H , H ,  S , S ,  F и F и  G для этого процесса. G для этого процесса.
7.Стандартные энергии Гиббса и Гельмгольца при
700°С для химической реакции:
CaCO3(тв) = CaO (тв) + CO2(г) .
Может ли эта реакция протекать самопроизвольно
при данной температуре и стандартных состояниях
реагентов? Теплоемкости веществ считать
постоянными.
8. Используя справочник «Термодинамические
свойства индивидуальных веществ», рассчитайте  rU , rU ,  rH , rH ,  rF и rF и  rG при 700 К реакции rG при 700 К реакции
PCl 5 ( g ) = PCl3 + Cl2
Сравните результаты расчета стандартной
энергии Гиббса через энтальпию и энтропию
реакции и через приведенные потенциалы.
Семинар 4. Растворы
1. На рисунке представлена зависимость
давления пара одного компонента раствора от
состава бинарной смеси при постоянной
температуре. Предложите графическую
интерпретацию активности и коэффициента
активности этого компонента в симметричной и
асимметричной системе сравнения
2. Для раствора вода – н -пропанол при 25 °
C получены следующие данные:
| x н -пропанола (р-р) |
0 |
0.02 |
0.05 |
0.10 |
0.20 |
0.40 |
0.60 |
0.80 |
1.00 |
| p воды , кПа |
3.17 |
3.13 |
3.09 |
3.03 |
2.91 |
2.89 |
2.65 |
1.79 |
0.00 |
| p н -пропанола , кПа |
0.00 |
0.67 |
1.44 |
1.76 |
1.81 |
1.89 |
2.07 |
2.37 |
2.90 |
Рассчитайте активности и коэффициенты
активности обоих компонентов в растворе с
мольной долей н -пропанола 0.40 в обеих
системах сравнения.
3. Энергия Гиббса смешения жидких растворов K - Rb
описывается уравнением  mix G = RT mix G = RT  {(1 – x ) ln (1 – x ) + x ln x ) + (1 - x)
x
{(1 – x ) ln (1 – x ) + x ln x ) + (1 - x)
x  (–56.334 + 8.251 (–56.334 + 8.251  x ). Выведите выражение для расчёта
концентрационной зависимости химического
потенциала калия.
x ). Выведите выражение для расчёта
концентрационной зависимости химического
потенциала калия.
4. Покажите, при каких условиях будет неустойчив
квазирегулярный раствор
5. 68.4 г сахарозы растворено в 1000 г воды.
Рассчитайте: а) давление пара, б) осмотическое
давление, в) температуру замерзания, г)
температуру кипения и замерзания раствора. Как
изменятся эти величины, если растворить 0.2 моля
NaCl ? Давление пара чистой воды при 20°C равно 2314.9
Па. Криоскопическая и эбулиоскопическая
постоянные воды равны 1.86 и 0.52 К  кг
кг  моль –1 соответственно. моль –1 соответственно.
Семинар 5. Однокомпонентные
системы .
1.Выведите правило фаз Гиббса. Определите число
степеней свободы системы, состоящей из CO , CO 2 ,
O2 , H2 , H2O при 400 К. Как изменится
ее вариантность, если:
a) система находятся во внешнем поле
б)образование воды кинетически затруднено.
в)температура понизится до 300 К.
2. Вычислите летучесть аммиака при температуре
473 К и давлениях 100 и 400 атм, исходя из
экспериментальной зависимости давления газа от
его мольного объема
P , атм |
20 |
60 |
100 |
150 |
200 |
250 |
300 |
400 |
V m , см 3
моль-1 |
1866 |
570,8 |
310,9 |
176,7 |
107,4 |
74,18 |
59,60 |
47,68 |
Получите выражение для расчета летучести в
предположении, что аммиак подчиняется уравнению
Ван-дер-Ваальса
3.Зависимости давления насыщенного пара над
некоторой чистой жидкостью ( p *) и твердым
веществом ( p ) описывается уравнениями
ln p * = a1 + b1ln T
- c 1/T , ln p = a2 + b2ln
T - c2 / T ,
a)Определите координаты тройной точки;
b)Выразите мольную теплоту испарения жидкости  v H и сублимации v H и сублимации  s H через параметры a , b
, c ; s H через параметры a , b
, c ;
c)Определите мольную теплоту плавления вещества;
d)Определите разность мольных теплоемкостей
жидкой и твердой фазы
4.Гидрохлорид метиламина ( NH3 CH3Cl )
существует в двух кристаллических модификациях (
 и и  ). Вычислите теплоту
обратимого фазового перехода при 220.4 К и 1 атм,
если известно, что при 19.5 К теплоемкость ). Вычислите теплоту
обратимого фазового перехода при 220.4 К и 1 атм,
если известно, что при 19.5 К теплоемкость  -формы равна 5.99 Дж моль -1 К -1 , а
теплоемкость -формы равна 5.99 Дж моль -1 К -1 , а
теплоемкость  -формы при 12 К составляет
8.48 Дж моль -1 К-1. Теплоемкость обеих
модификаций описывается в интервале температур
0-20 К уравнением кубов Дебая. Изменение энтропии -формы при 12 К составляет
8.48 Дж моль -1 К-1. Теплоемкость обеих
модификаций описывается в интервале температур
0-20 К уравнением кубов Дебая. Изменение энтропии
 -формы в интервале 12-220.4 К равно
93.77 Дж моль -1 К-1 , а -формы в интервале 12-220.4 К равно
93.77 Дж моль -1 К-1 , а  S S = 100.3 Дж моль -1 К-1 в
интервале 19.5-220.4 К. = 100.3 Дж моль -1 К-1 в
интервале 19.5-220.4 К.
Семинар 6. Бинарные
системы
1.Считая бензол и хлорбензол компонентами
идеального раствора, постройте 1) зависимость p
i и P от состава раствора при 100 С, 2)
зависимость P от состава пара при 100 С, 3)
зависимость T кип от состава пара и состава
раствора при 760 мм рт. ст. В таблице приведены
T , o C |
80 |
90 |
100 |
110 |
120 |
p s ( C6H6),
мм |
760 |
1008 |
1338 |
1740 |
2215 |
p s ( C6H5Cl
), мм |
- |
208 |
293 |
403 |
542 |
2.При давлении 760 мм рт.ст. бензол и хлорбензол
плавятся при 5,5 С и -45.6 o С, соответственно.
Мольные энтальпии плавления равны 9837 Дж моль -1
К-1 , 9556 Дж моль -1 К-1 . Постройте
диаграмму плавкости системы, предположив, что
компоненты образуют идеальный жидкий раствор и
нерастворимы в твердом состоянии.
3. Рассчитайте (в общем виде) кривую ликвидуса
соединения АВ, если известны температура
плавления ( T m ), энтальпия (  f H ) и энтропия ( f H ) и энтропия (  f S ) образования
твердого соединения из жидких компонентов.
Примите, что жидкость можно считать идеальным
раствором f S ) образования
твердого соединения из жидких компонентов.
Примите, что жидкость можно считать идеальным
раствором
Семинары 7-8. Химическое
равновесие
1. Рассчитать степень диссоциации N2 O4
при 25o С и давлении 105 Па. Исходные
данные
| |
N2O4 |
NO2 |
 f H o 298 , кДж/моль f H o 298 , кДж/моль |
9.16 |
33.2 |
| S o298 , Дж/К/моль |
304.3 |
240.5 |
Покажите, как изменится степень диссоциации
при повышении 1) температуры, 2) давления?
2. Рассчитайте степень диссоциации 2 г SO2 Cl2
на SO2 и Cl2 при 120 o С, помещенных в
объем 0.5 л. Энтальпии образования SO2Cl2
и SO2 при 298 К составляют -355 и -296.8 кДж/моль. К
p (298 К) = 1.6 10 -4 . Как изменится
степень диссоциации при добавлении n молей
инертного газа? 10 -4 . Как изменится
степень диссоциации при добавлении n молей
инертного газа?
3. Константа равновесия реакции Fe3O4(тв)
+ CO  3FeO (тв) + CO2 при 600° С равна
1.15. Смесь 1 моля Fe3O4 , 2 молей CO , 0.5 моля
FeO и 0.3 моля CO2 нагрета до 600 ° С при общем
давлении 5 атм. Определите количество каждого
вещества при равновесии. Изменится ли состав
равновесной смеси при повышении давления до 5
атм? 3FeO (тв) + CO2 при 600° С равна
1.15. Смесь 1 моля Fe3O4 , 2 молей CO , 0.5 моля
FeO и 0.3 моля CO2 нагрета до 600 ° С при общем
давлении 5 атм. Определите количество каждого
вещества при равновесии. Изменится ли состав
равновесной смеси при повышении давления до 5
атм?
4. Для реакции разложения известняка давление
диссоциации при 800° С равно 0.26  105
Па, а при 1000 С равно 4.8 105
Па, а при 1000 С равно 4.8  105 Па. Найти
средние значения 105 Па. Найти
средние значения  rHo и rHo и
 rS o для этой
реакции в данном интервале температур, а также
давление диссоциации при температуре 1157 К. rS o для этой
реакции в данном интервале температур, а также
давление диссоциации при температуре 1157 К.
5. Экспериментально измеренное давление NаF над
расплавом неизвестного состава составило 7.5 10-7
атм. Определить активность NаF в этом расплаве,
если 10-7
атм. Определить активность NаF в этом расплаве,
если  f Ho(0) NаF, I =
-574.210, f Ho(0) NаF, I =
-574.210,  f Ho(0)NаF,g =
-293.510 кДж/моль; ФNаF, I (1200) =78.038, ФNаF,g(1200)
=232.923 Дж/моль К. f Ho(0)NаF,g =
-293.510 кДж/моль; ФNаF, I (1200) =78.038, ФNаF,g(1200)
=232.923 Дж/моль К.
6. При комнатной температуре серебро на воздухе
окисляется. Однако при нагревании пленка оксида
исчезает. Оцените температуру, при которой оксид
неустойчив.  f Ho 298
(Ag2O) =- 7 ккал/моль, f Ho 298
(Ag2O) =- 7 ккал/моль,  f So 298
(Ag 2 O) = -15.3 кал/моль/К. f So 298
(Ag 2 O) = -15.3 кал/моль/К.
7. Металлический Ti при 1600 К находится в
атмосфере H 2 , содержащего следы влаги.
Найти максимально допустимый процент содержания
H2O в H2, при котором не будет
происходить окисления Ti .  f Go(1600) TiO =
-94.6 ккал/моль, f Go(1600) TiO =
-94.6 ккал/моль,  f Go (1600) H2O
= -37.9 ккал/моль. f Go (1600) H2O
= -37.9 ккал/моль.
8. При невысоких температурах и давлениях,
близких к атмосферному, реакции дегидрирования и
дегидратации изопропилового спирта протекают
параллельно. Рассчитайте состав равновесной
газовой смеси при 400 К, если для реакций
| C3 H7OH = (CH3)2CO + H2 |
K a,1 =0.0195 |
| C3H7OH = C3H6 + H2O |
K a,2 =3.24 |
|
