Тема: Синтетические задачи
Цель работы: изучение методов синтеза и химических свойств важного класса макроциклических соединений - каликсаренов. Выполнение синтеза одного из п-трет-бутилкакликс[n]аренов (n= 4, 6, 8).
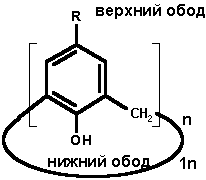
Введение. Каликсарены 1n (Рис. 1) представляют собой циклические олигомеры, состоящие из фенольных фрагментов, связанных метиленовыми мостиками [1, 2].
Термин "каликс[n]арен" был введен в литературу Гютше с сотр. в 1978 г. "Каликс" - от греческого "чаша, кубок" - говорит о специфической, корзиноподобной форме молекулы, "арен" свидетельствует о наличии ароматических циклов в макроциклическом ансамбле, цифра в квадратных скобках указывает на размер макроцикла, а природа и положение заместителей в ароматическом ядре уточняется соответствующими цифрами и дескрипторами (Рис. 1). Например, соединение 1n, где n=4, R=трет-бутил , по этой номенклатуре будет называться 5, 11, 17, 23 -тетра-трет-бутил-25, 26, 27, 28-тетрагидроксикаликс[4]ареном или, сокращенно, п-трет-бутил-каликс[4]ареном, нумерация атомов в котором, приведена на рисунке 1.


Рис. 1
СПОСОБЫ ПОЛУЧЕНИЯ КАЛИКСАРЕНОВ
Конденсация п-замещенных фенолов с формальдегидом в присутствии основания.
В начале XX века Бакеланд на основе взаимодействия фенола с формальдегидом разработал способ получения твердой упругой смолы – бакелита, которая стала пользоватся огромным успехом в промышленности. Это послужило стимулом интенсивного исследования различных этапов получения фенопластов. В начале 40-х годов Цинке с сотр., изучавший стадию отверждения фенолов, обрабатывали разнообразные п-замещенные фенолы водными растворами формальдегида и NaOH при различных температурах. Им удалось получить высокоплавкие и малорастворимые вещества, которым были приписаны структуры циклических тетрамеров.
В 1953 г. Корнфорт показал, что в результате этой реакции образуется не одно, как считал Цинке , а несколько соединений. В случае п-трет-бутил- и п-трет-октил фенолов были выделены легко- и высокоплавкие фракции, которым, согласно молекулярным весам и предварительным данным РСА, были приписаны структуры конформационных изомеров циклического тетрамера. Однако, в 1972 г. этот вывод был опровергнут работами Каммерера, а позднее - Манча , исследовавших ПМР-спектры полученных соединений при различных температурах и показавших, что уже при 20oС конформации п-трет-бутил-каликс[4]арена быстро переходят друг в друга. В середине 70-х американский профессор Д. Гютше с сотр показал, что в результате конденсации п-трет-бутил-фенола с формальдегидом образуются смеси циклических олигомеров с различными размерами цикла, в основном, с четным числом звеньев - каликс[n]арены (1) (R = п-трет-бутил, n=4, 6, 8).
В настоящее время конденсация п-замещенных фенолов с формальдегидом в присутствии оснований применяется обычно в трех модификациях, отличающихся друг от друга следующим:
Предполагается , что на первой стадии процесса конденсации фенола с формальдегидом под действием основания образуются 2-гидрооксиметил- и 2,6-бис(гидроксиметил)фенолы. Взаимодействие этих соединений с исходным фенолом, возможно, по реакции Михаэлиса, дает линейные димеры, тримеры и т.д.. Тот факт, что циклические олигомеры с четным числом членов в ряду п-трет-бутил-каликс[n]аренов образуются предпочтительно (максимально достигнутый выход п-трет-бутил-каликс[5]арена - 5% [24], а п-трет-бутил-каликс[7]арена 6%), позволяет предположить наличие общего димерного предшественника, который в результате ди-, три- и тетрамеризации может образовывать каликсарены 1n, где R=трет-бутил, n= 4, 6 или 8.
Согласно данным Бомера, основанным на результатах РСА, линейный тетрамер под действием водородных связей приобретает зигзагообразную конформацию. Для образования каликс[4]арена ему необходимо "сложиться пополам". С другой стороны, зигзагообразная конформация идеально подходит для образования и каликс[8]арена. Существенная роль водородных связей в процессе циклизации подтверждается и тем, что при замене неполярных растворителей - ксилола, дифенилового эфира или тетралина - на хинолин выход каликсаренов падает практически до нуля.
Другим важным фактором, влияющим на процесс циклизации, по-видимому, является темплатный эффект катиона основания. Эксперименты Гютше показали, что необходимым условием циклизации по методу Цинке-Корнфорта является неполное удаление катионов натрия из смолы, содержащей линейные предшественники каликсаренов. Сообщалось, что выход циклического гексамера, главного продукта реакции при использовании стехиометрического количества основания, несколько выше для гидроксида рубидия, по сравнению с гидроксидами цезия, калия или натрия.
При каталитических количествах основания состав полученных смесей каликсаренов перестает зависить от природы катиона основания. Гидроксид лития как катализатор неэффективен при получении всех видов каликсаренов, кроме октамера. Вероятно, в процессе циклизации линейные предшественники определенным образом координируются вокруг подходящих по размеру катионов основания. Изат с сотрудниками показали, что каликсарены действительно проявляют ионофорные свойства по отношению к катионам натрия, калия, рубидия и цезия, но не лития.
Было детально исследовано влияние условий реакции (температуры, скорости нагрева, времени, наличия воды в реакционной смеси) на ее результат. Оказалось, что состав продуктов конденсации фенолов с формальдегидом в значительной степени зависит от количества вводимого в реакцию основания. Так, при соотношении NaOH / п-трет-бутилфенол 0,037 выход тетрамера составляет 60%, а при соотношении 0,15 - только 35% . При стехиометрическом количестве основания в продуктах реакции преобладает каликс[6]арен. При дальнейшем увеличении количества основания выход всех каликсаренов быстро падает. Вероятно, это связано с возникновением полианионов линейных олигомеров, которые из-за электростатического отталкивания не способны образовывать геми- и псевдокаликсарены.
Долгое время считалось, что циклические олигомеры не переходят друг в друга. Однако, в 1986 году было показано ,что в условиях получения каликсаренов по Цинке-Корнфорту циклический гексамер превращается в циклический тетрамер, а циклический октамер - с выходом более 75% - в тетрамер, причем при использовании большего количества основания превращение происходит менее полно. Механизм такого "химического митоза" приведен на рисунке 2.
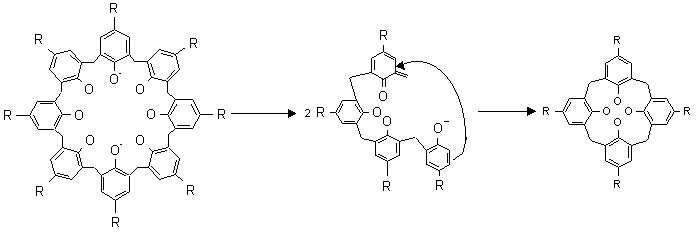
Рис 2 .
Существенное влияние на состав смесей образующихся каликсаренов оказывает природа пара-заместителя в исходном фенольном субстрате. Фенолы с электроноакцептороными группами, такими как галоген-, нитро-, метоксикарбонил-, каликсаренов не образуют. Сообщение об образовании циклических тетрамеров с пара-оксиметильной или метоксикарбонильной группами впоследствии не подтвердилось.
Постадийные синтезы каликсаренов.
В 1956 году Хейс и Хантер попытались получить дополнительное доказательство существования структур, предложенных Цинке, осуществив "рациональный" (название авторов) или ступенчатый синтез п-метилкаликс[4]арена. Каммерер с сотрудниками усовершенствовал синтез Хейса и Хантера и получил ряд метил- и трет-бутил- замещенных каликс[n]аренов (n = 4, 5, 6 , 7). Данный ступенчатый синтез имеет ряд недостатков: он продолжителен, и целевой продукт получается с весьма скромным общим выходом (около 11%) для п-трет-бутил-каликс[4]арена и всего лишь 0,5% для п-фенил -производного.
Учитывая эти недостатки Бомер с сотр. разработали более короткий путь получения каликсаренов, сохраняющий гибкость постадийного синтеза:
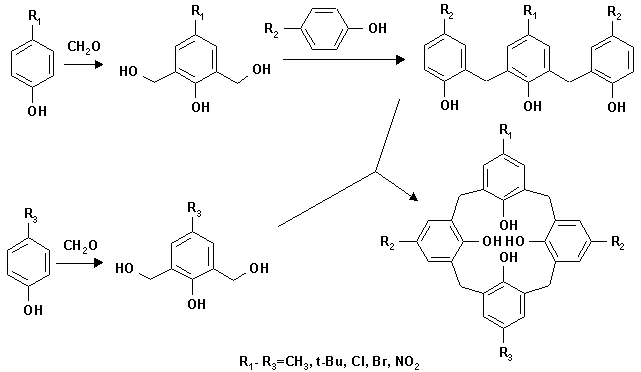
Однако, выходы на стадии циклизации оказались небольшими: от 10 – 20% для соединений с алкильными заместителями до 2 – 7% для соединений, содержащих нитро- группу или галоген. В 1987 году Бомер в постадийном синтезе каликс[4]арена впервые использовал тетрахлорид титана. Выходы полученных производных колеблются от 12 – 14% до 3 – 9% (для каликсаренов, содержащих электроноакцепторные группы).
Мендоза с сотрудниками использовал конденсацию в присутствии тетрахлорида титана по схеме "3+1" для получения каликс[6]аренов, а также каликс[4]аренов, содержащих не менее двух электроноакцепторных групп ( хлор-, этоксикарбонил- и нитро-). Выходы последних достигали 30 %. Впоследствии сообщалось о получении 20 новых производных, в которых два противоположных ароматических кольца связаны углеводородной цепью.
Из приведенных литературных данных следует, что наиболее эффективными и удобными являются дающие высокие выходы способы получения каликс[4]аренов путем конденсации п-алкилфенолов с формальдегидом и присутствии основания. В тоже время этот метод малопригоден для получения макроциклов с нечетным числом арильных фрагментов, а также соединений, содержащих в пара-положении электроноакцепторные группы.
Постадийный синтез каликсаренов хотя и позволяет синтезировать соединения с любым фиксированным числом ароматических фрагментов и с различными заместителями в них, тем не менее, имеет ряд недостатков: он весьма трудоемок и приводит к получению каликсаренов с малым общим выходом.
МЕТОДЫ СИНТЕЗА КАЛИКС[n]АРЕНОВ.
Синтез п-трет-бутилкаликс[n]аренов.
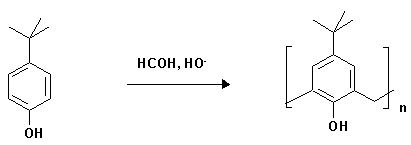
1.1. п-трет-Бутилкаликс[4]арен.
В колбу Эрленмейера объемом 500 мл помещают 20 г (133 ммоль) п-трет-бутилфенола, 13.5 г (12.46 мл, 166 ммоль) 37%-ного раствора формалина, 0.24 г (30 ммоль) NaOH, растворенного в минимальном количестве воды. Содержимое колбы нагревают на масляной бане в течение 1.5-2 ч., поддерживая температуру в бане 110-120o С. В течение этого периода цвет смеси изменяется от бледно-желтого к интенсивно-желтому (оранжевому). По окончании нагревания колбу охлаждают до комнатной температуры (содержимое колбы назовем "прекурсором").
"Прекурсор" измельчают, помещают в трехгорлую колбу, снабженную обратным холодильником и механической мешалкой, и суспендируют в 200-250 мл дифенилового эфира. Первые 40-100 мин. реакцию проводят при снятом обратном холодильнике, слабом нагревании и усиленной подаче азота. В это время "прекурсор" сначала растворяется в дифениловом эфире, а затем образуется обильный осадок. После выпадения осадка реакционную смесь кипятят с обратным холодильником в течение 2.5-3 ч (осадок растворялся в первые 30-40 мин.). Затем содержимое колбы при перемешивании охлаждают до комнатной температуры, добавляют 100-150 мл этилацетата. Осадок отфильтровывают на стеклянном фильтре, кристаллизуют из толуола, сушат над P2O5. Полученный продукт выделяется в виде блестящих пластинок. Выход 13.4 г (62.5%), т. пл. 344-346o С; Rf 0.53 (элюент CHCl3 : гексан = 3:4).
Литература:
(a) Gutsche D., Dhawan B., No K., Muthukrishnan R. J. Am. Chem. Soc., 1981, 103(13),
3782-3792.
(b) Gutsche D., Iqbal M., Stewart D. J. Org. Chem., 1986, 51(5),
742-745.
п-трет-Бутилкаликс[6]арен.
В трехгорлую колбу (500 мл) , снабженную мешалкой,
насадкой Дина-Старка с обратным холодильником и
газоподводящей трубкой, помещают 10.0 г (66 ммоль ) п-трет-бутилфенола,
4.0 г (133 ммоль) параформа, 6 мл 5 N гидроксида
рубидия и 100 мл о-ксилола. Реакционную смесь
кипятят при перемешивании в слабом токе азота в
течение 4 часа. Охлажденную реакционную смесь
отфильтровывают и остаток суспендируют в 300 мл CHCl3
и встряхивают со 100 мл 1 N HCl. Органический слой
отделяют, промывают водой, высушивают над Na2SO4
и концентрируют до 100 мл. При добавлении метанола
выпадает осадок, который отфильтровывают и
получают 7.85 г (73%) бесцветного целевого продукта;
т. пл. 380-381o С; Rf 0.63 (элюент CHCl3 : гексан
= 3:4). После рекристаллизации из CHCl3 или
смеси CHCl3/СН3ОН получают целевой
продукт с той же температурой плавления.
Литература:
Gutsche D., Dhawan B., No K., Muthukrishnan R.
J. Am. Chem. Soc., 1981, 103(13), 3782-3792.
1.3. п-трет-Бутилкаликс[8]арен.
В трехгорлую колбу (500 мл) , снабженную мешалкой, насадкой Дина-Старка с обратным холодильником и газоподводящей трубкой, помещают 27.8 г (180 ммоль ) п-трет-бутилфенола, 9.0 г (300 ммоль) параформа, 0.224 г (4 ммоль) едкого кали ( 0.56 мл 32.4%-ного раствора) и 150 мл о-ксилола. Реакционную смесь кипятят при перемешивании в слабом токе азота в течение 6 часов. Осадок отделяют на стеклянном фильтре и промывают последовательно порциями по 100 мл: толуола, бензола, эфира, ацетона, воды и снова ацетона. Полученный белый порошок кристаллизуют из хлороформа и высушивают на воздухе. Выход 22.0 г (69%.); т. пл. 411-412o С; Rf 0.75 (элюент CHCl3 : гексан = 3:4).
Литература:
(a) Gutsche D., Dhawan B., No K., Muthukrishnan R.
J. Am. Chem. Soc., 1981, 103(13), 3782-3792.
Синтез п-Н-каликс[n]аренов.
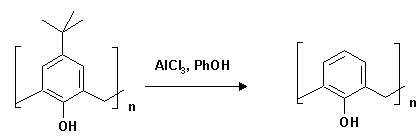
2.1. п-Н-Бутилкаликс[4]арен.
Взвесь 13.3 г (20 ммоль) п-трет-бутилкаликс[4]арена, 9.02 г (96 ммоль) фенола, 14 г (105 ммоль) хлористого алюминия в 125 мл абсолютного толуола перемешивают при комнатной температуре в токе азота в течение одного часа. Содержимое колбы выливают в 250 мл 0.2 N раствора HСl, отделяют органический слой, растворитель отгоняют, к остатку прибавляют метанол. Образовавшийся осадок отмывают горячей смесью метанола и хлороформа (3:1). Полученный каликс[4]арен выделяют в виде бесцветных кристаллов. Выход 6.77 г (77%); т. пл. 313-315o С; Rf 0.00 (элюент CHCl3 : гексан = 3:4).
Литература:
Gutsche D., Lin L.
Tetrahedron, 1986, 42(6), 1633-1640.
2.2. п-Н-Бутилкаликс[6]арен.
Взвесь 10.54 г (11 ммоль) п-трет-бутилкаликс[6]арена, 6.19 г (66 ммоль) фенола и 11.75 г (88 ммоль) хлористого алюминия в 125 мл абсолютного толуола перемешивают при комнатной температуре в токе азота в течение одного часа. К реакционной смеси прибавляют 100 мл ледяной воды и органический слой отделяют. Толуол отгоняют и к остатку добавляют 70 мл метанола, получают 6.81 г продукта реакции. После рекристаллизации из смеси метанол-хлороформ получаю 6.13 (89%) п-Н-бутилкаликс[6]арена: белый порошок; т. пл. 417-418o С.
Литература:
Gutsche D., Lin L.
Tetrahedron, 1986, 42(6), 1633-1640.
2.3. п-Н-бутилкаликс[8]арен.
Взвесь 10.0 г (7.7 ммоль) п-трет-бутилкаликс[8]арена, 5.8 г (62 ммоль) фенола и 12.35 г (93 ммоль) хлористого алюминия в 150 мл абсолютного толуола обрабатывают аналогично описанному для гекса- и тетрамеров, выделяют 11.4 г продукта реакции (оранжевый порошок). Осадок промывают смесью ацетон-НСl, метанолом, хлороформом, ацетоном и диэтиловым эфиром, получают 6.10 г (93%) слегка серого вещества; т. пл. >450o С.
Литература:
Gutsche D., Lin L. Tetrahedron, 1986, 42(6), 1633-1640.
Литература