


Ткани и органы. Иммунная система
Антитела
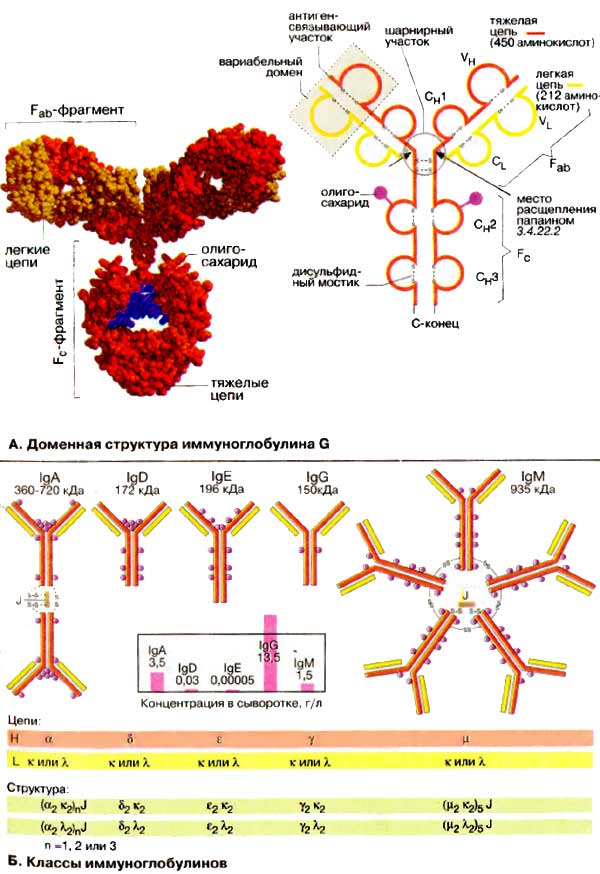 А. Доменная структура иммуноглобулина G
А. Доменная структура иммуноглобулина G
Иммуноглобулины (Ig), или
антитела, являются семейством Y-образных (по пространственной структуре)
гликопротеинов, у которых обе вершины («буквы Y») могут связывать антиген.
Иммуноглобулины находятся в виде мембранных белков на поверхности лимфоцитов и в
свободном виде в плазме крови. На схеме показана структура наиболее важного из
них — иммуноглобулина класса G (IgG). Молекула представляет собой крупный
тетрамер (Н2L2 с 150 кДа) из двух идентичных тяжелых
цепей (Н-цепей, на схеме красного или оранжевого цвета) и двух идентичных
легких цепей (L-цепей, на схеме желтого цвета). В обеих H-цепях имеется
ковалентно связанный олигосахарид (на схеме фиолетового цвета; см. также
рис. 51).
Иммуноглобулины расщепляются протеиназой
папаином на два Fab-фрагмента и один Fc-фрагмент.
Оба Fab-фрагмента (от англ. antigen binding fragment —
антиген-связывающий фрагмент) состоят соответственно из одной L-цепи и
N-концевой части H-цепи. Изолированные Fab-фрагменты сохраняют
способность связывать антиген. Fс-Фрагмент (от англ. fragment
crystallizable — способный кристаллизоваться) состоит из С-концевой половины
обеих H-цепей. Эта часть IgG выполняет функции связывания с клеточной
поверхностью, взаимодействия с системой комплемента и участвует в переносе
антител клетками.
Несмотря на большое разнообразие в
иммуноглобулинах соблюдается общий принцип строения. Обе тяжелые пептидные цепи
(Н-цепи) IgG состоят из четырех глобулярных доменов VH,
СH1, СH2 и СH3, обе легкие (L-
цепи) — из двух глобулярных доменов CL и VL.
При этом буквы С и V соответственно обозначают константные (англ. constant) и
вариабельные (англ. variable) области. Обе тяжелые цепи, а также тяжелая цепь с
легкой, связаны дисульфидными мостиками. Дисульфидные мостики внутри
доменов стабилизируют третичную структуру. Домены имеют длину около 110
аминокислот и обладают взаимной гомологией (см. с. 292). Такая структура
антител, очевидно, возникла благодаря дупликации гена.
В центральной области молекул
иммуноглобулинов расположен шарнирный участок, который придает антителам
внутримолекулярную подвижность.
Б. Классы
иммуноглобулинов
Иммуноглобулины человека по структуре
тяжелых цепей делятся на пять классов. Различия между IgA (с двумя
подклассами), IgD, IgE, IgG (с четырьмя подклассами) и IgM
определяются H-цепями, которые обозначаются греческими буквами — α, β, ε,
γ и μ. L-Цепи имеют только две разновидности (κ и λ). IgM могут
существовать в различных формах. Секретируемые IgM состоят из пяти
взаимосвязанных димеров. IgA могут быть образованы из одного, двух или трех
димеров. Олигомерные IgM и IgA удерживаются вместе благодаря связывающему
J-пептиду (от англ. joining).
Иммуноглобулины всех пяти классов
являются секретируемыми белками. Они поставляются в кровь зрелыми В-клетками
(плазматическими клетками, см. с. 286), Ранние варианты IgM и IgD найдены также
в виде интегральных мембранных белков на поверхности В-клеток (см. с.
292).
Антитела имеют различные функции. При контакте с чужеродным
антигеном первыми образуются lgM-антитела. Ранние формы IgM связаны с
поверхностью В-клеток (см. с. 292), более поздние формы
секретируются в виде пентамеров плазматическими клетками. Антитела IgM особенно
активны против микроорганизмов. В количественном отношении превалируют антитела
IgG (см. таблицу сывороточных концентраций белков). Они находятся в крови
и в интерстициальной жидкости; с помощью рецепторов они могут также проходить
в плаценту и вследствие этого переноситься от матери к плоду. IgA обнаруживаются
преимущественно в кишечном тракте и секретах. IgE присутствуют в плазме
здорового человека лишь в незначительных, концентрациях. Повышение уровня IgE
наблюдается при аллергических реакциях и паразитарных инфекциях*.
Количества в плазме IgD, функция которого еще не выяснена, также весьма
малы.
_________
*IgE является атоническим (кожно-сенсибилизирующим)
иммуноглобулином (реагином, см. рис. 271) — Прим. перев.