


Метаболизм. Регуляция
Гормональный контроль
 Катализируемые ферментами
активация и соответственно инактивация ключевых ферментов промежуточного метаболизма
называются взаимопревращениями. Такие процессы находятся под
разнообразным контролем, и том числе и гормональным. В этом разделе рассмотрены
процессы взаимопревращений, осуществляющие регуляцию метаболизма гликогена в
печени.
Катализируемые ферментами
активация и соответственно инактивация ключевых ферментов промежуточного метаболизма
называются взаимопревращениями. Такие процессы находятся под
разнообразным контролем, и том числе и гормональным. В этом разделе рассмотрены
процессы взаимопревращений, осуществляющие регуляцию метаболизма гликогена в
печени.
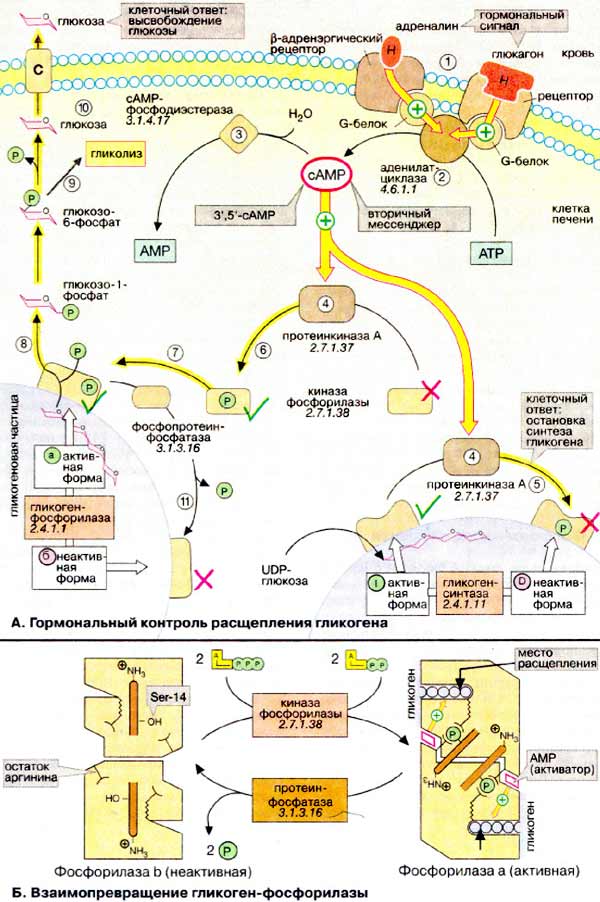
А. Гормональный контроль расщепления
гликогена
Гликоген служит в организме резервом
углеводов, из которого в печени и мышцах путем расщепления быстро создается
глюкозофосфат (см. с. 158). Скорость синтеза гликогена определяется активностью
гликоген-синтазы (на схеме внизу справа), в то время как расщепление
катализируется гликоген-фосфорилазой (на схеме внизу слева). Оба фермента
действуют на поверхности нерастворимых частиц гликогена, где они в зависимости
от состояния обмена веществ могут находиться в активной или неактивной форме.
При голодании или в стрессовых ситуациях (борьба, бег) возрастает потребность
организма в глюкозе. В таких случаях выделяются гормоны адреналин и
глюкагон. Они активируют расщепление и ингибируют синтез гликогена.
Адреналин действует в мышцах и печени, а глюкагон — только в
печени.
Оба гормона связываются с рецепторами на плазматической
мембране (1) и активируют при посредничестве G-белков
(см. с. 372) аденилатциклазу (2),
которая катализирует синтез 3',5'-цикло-AMФ (цАМФ) из АТФ (АТР). Зеркально противоположным
является действие на этот «вторичный мессенджер» фосфодиэстеразы цАМФ
(3), гидролизующей цАМФ до АМФ (AMP). В печени
диэстераза индуцируется инсулином, который поэтому не препятствует воздействию
двух других гормонов (не показано). цАМФ связывается и тем самым активирует
протеинкиназу А (4), которая действует по
двум направлениям: с одной стороны, с помощью фосфорилирования с участием
АТФ в качестве кофермента она переводит в неактивную D-форму гликоген-синтазу
и вследствие этого останавливает синтез гликогена (5);
с другой, активирует — также путем фосфорилирования — другую протеинкиназу,
киназу фосфорилазы (8). Активная киназа
фосфорилазы фосфорилирует неактивную b-форму гликоген-фосфорилазы, превращая
ее в активную а-форму (7). Это приводит к высвобождению
из гликогена глюкозо-1-фосфата (8), который после
превращения в глюкозо-6-фосфат с участием фосфоглюкомутазы включается в гликолиз
(9). В печени дополнительно образуется свободная
глюкоза, которая поступает в кровь (10).
По мере уменьшения уровня цАМФ активируются фосфопротеинфосфатазы
(11), которые дефосфорилируют различные фосфопротеины
описанного каскада и тем самым останавливают расщепление гликогена и инициируют
его синтез. Эти процессы протекают в течение нескольких секунд, так что метаболизм
гликогена быстро адаптируется к измененным условиям.
Б. Взаимопревращение
гликоген-фосфорилазы
Структурные изменения, которые
сопровождают взаимопревращения гликоген-фосфорилазы, были установлены
рентгеноструктурным анализом. Фермент представляет собой димер с
симметрией второго порядка. Каждая субъединица имеет активный центр, который
расположен внутри белка и в b-форме плохо доступен для субстрата.
Взаимопревращение начинается с фосфорилирования серинового остатка
(Ser-14) вблизи N-конца каждой из субъединиц. С фосфатными группами
связываются остатки аргинина соседних субъединиц. Связывание инициирует
конформационные перестройки, которые существенно увеличивают сродство фермента к
аллостерическому активатору АМФ. Действие АМФ и влияние конформационных
изменений на активные центры приводят к возникновению более активной а-формы.
После удаления фосфатных остатков фермент самопроизвольно принимает исходную
b-конформацию.