Глава 2. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
2.1. Теоретическая часть
Раздел химии, изучающий тепловые эффекты
химических реакций называется термохимией.
Все химические процессы сопровождаются
выделением или поглощением теплоты. Реакции,
сопровождающиеся выделением теплоты из системы
в окружающую среду, называются экзотермическими,
сопровождающиеся поглощением теплоты из
окружающей среды, называются эндотермическими.
Тепловой эффект реакции, измеренный при
постоянных температуре и давлении, называется
теплотой реакции Qр, а
противоположная ему по знаку величина,
описывающая изменение состояния системы в
результате протекания реакции энтальпией
реакции ![]() rH.
rH.
В качестве основной единицы измерения теплоты в системе СИ установлен джоуль. В качестве единицы измерения теплоты встречается также калория, равная 4,184 Дж. В настоящее время она сохраняется как внесистемная единица для сравнения результатов современных работ с экспериментальными и справочными данными, накопленными за многие предыдущие годы.
Для описания тепловых явлений в
химических реакциях принято пользоваться так
называемыми термохимическими уравнениями.
Термохимические уравнения записываются как
обычные уравнения химических реакций, но с
указанием величины и знака теплового эффекта
реакции. В случае экзотермических реакций с
правой стороны уравнения отмечают количество
выделившейся теплоты со знаком "плюс", а в
случае эндотермических реакций — количество
поглощенной теплоты со знаком "минус". При
этом у формулы каждого вещества индексом
указывается его физическое состояние:
газообразное (г), жидкое (ж), кристаллическое (к)
или раствор (р-р).Существует термодинамический
способ записи термохимических уравнений —
когда в самом уравнении тепловой эффект не
указывается, а изменение энтальпии реакции (![]() H)
записывается отдельно. Пример записи
термохимического уравнения реакции образования
карбоната кальция из простых веществ обоими
способами:
H)
записывается отдельно. Пример записи
термохимического уравнения реакции образования
карбоната кальция из простых веществ обоими
способами:
Caк + C(гр )к+ 3/2O2,г
= CaCO3,к + 1206,8 кДж;
Caк + C(гр )к+ 3/2O2,г = CaCO3,к
, H = –1206,8 кДж
В данной реакции Q > 0, соответственно, ![]() H <
0, реакция является экзотермической.
H <
0, реакция является экзотермической.
Реакции, в которых образуется 1 моль вещества из соответствующих ему простых веществ, взятых в определенном состоянии (как правило, наиболее устойчивом при данной температуре и нормальном давлении), образуются сложные называются реакциями образования этого вещества, а тепловые эффекты или энтальпии им соответствующие называются соответственно теплотами или энтальпиями образования. Например, вышеприведенная реакция представляет собой реакцию образования кристаллического карбоната кальция, а ее теплота и энтальпия равны теплоте и энтальпии образования этого вещества. Экспериментально определенные энтальпии образования табулированыобобщены в термодинамических таблицах и отнесены к стандартным условиям: температуре 25oС (27398,15 К) и давлению 1 атм.
Расчеты тепловых эффектов химических реакций основаны на применении закона Гесса (1836 г.): Тепловой эффект химической реакции при постоянном давлении и объеме, не зависит от способа ее проведения, а зависит лишь от начального и конечного состояния реагирующих веществ.
Например, растворение безводного сульфата меди:
CuSO4,к + nH2Oж = CuSO4,р-р + Q (2.1)
![]() Н = – Q
Н = – Q
можно представить в виде как сумму двух последовательно протекающих процессов:
CuSO4,к + 5Н2Ож = CuSO4 . 5H2Oк + Q1 (2.2)
![]() Н1
= – Q1
Н1
= – Q1
![]() Н2
= – Q2
Н2
= – Q2
Тогда, согласно закону Гесса, тепловой эффект или энтальпия растворения безводной соли (2.1) должны быть численно равняться сумме теплот или энтальпий образования кристаллогидрата (2.2) и его растворения (2.3): .
Q = Q1 + Q2 (2.4 а)
![]() Н
=
Н
= ![]() Н1
+
Н1
+ ![]() Н2
(2.4 б)
Н2
(2.4 б)
Значения теплоты растворения безводной соли Q и кристаллогидрата Q2 известны и составляют 66,11 и –11,5 кДж соответственно. Тогда тепловой эффект реакции образования кристаллогидрата может быть рассчитан по формуле:
Q1 = Q – Q2 = 66,11 кДж – (–11,51 кДж) = 77,69 кДж, (2.5)
соответственно энтальпия равна ![]() Н1
= –77,69 кДж.
Н1
= –77,69 кДж.
Реакция образования кристаллогидрата является
экзотермической.
Наиболее важное для практики следствие закона
Гесса: - энтальпия химической реакции равна
разности между суммой энтальпий образования
продуктов реакции минус и суммой энтальпийи
образования исходных веществ (реагентов).
![]() (2.6)
(2.6)
Например, значение энтальпии реакции между растворами сильной кислоты и сильного основания может быть получено по табличным данным энтальпий образования исходных веществ., если представить эту реакцию:, например
HCl(р-р) + NaOH(р-р) = NaCl(р-р) + Н2Ож
может быть получено по табулированным энтальпиям образования в виде реакций между ионами, поскольку эта реакция в действительности является реакцией между ионами H+ и OH–:
H+(р-р) + OH–(р-р) = Н2Ож (2.7)
Уравнение (2.7) - это уравнение реакции нейтрализации. Оно справедливо для всех реакций между сильной кислотой и сильным основанием, а следовательно и энтальпия этих реакцийодно и тоже для будет одна и та же.
Табличные значения энтальпий образования (![]() ) ионов Н+ и ОН– и
молекулы Н2Ож известны и
соответственно равны 0, –229,94 и –285,84 кДж/моль,
соответственно. Тогда, по формуле (2.6) тепловой
эффект реакции нейтрализации:
) ионов Н+ и ОН– и
молекулы Н2Ож известны и
соответственно равны 0, –229,94 и –285,84 кДж/моль,
соответственно. Тогда, по формуле (2.6) тепловой
эффект реакции нейтрализации:
![]() rHо =
rHо = ![]() fH(H2Oж
) –
fH(H2Oж
) – ![]() fH(H+р-р)
–
fH(H+р-р)
– ![]() fH(OH–р-р
) =
fH(OH–р-р
) =
–285,84 – (–229,94) = –55,9 кДж/моль
При нейтрализации слабой кислоты сильным основанием или сильной кислоты слабым основанием тепловой эффект реакции будет зависеть от того, какая слабая кислота или слабое основание вступает в реакцию. (Другими словами от природы этих веществ). Это связано с тем, что слабые кислоты и основания существуют в растворах преимущественно в виде молекул. Например, при нейтрализации уксусной кислоты щелочью:
CH3COOH + NaOH = NaCH3COO + Н2О
в действительности идет следующая реакция:
CH3COOH + OH– = CH3COO– + Н2О (2.8)
которой соответствует энтальпия  rH, не равная энтальпии
взаимодействия ионов водорода и гидроксила (2.7),
при нейтрализации сильной кислоты ильным
основанием.
rH, не равная энтальпии
взаимодействия ионов водорода и гидроксила (2.7),
при нейтрализации сильной кислоты ильным
основанием.
В то же время реакцию (2.8) можно представить в виде суммы двух процессов:
1) диссоциации кислоты
CH3COOH = CH3COO + Н+ ![]() Hдис
(2.9)
Hдис
(2.9)
2) и нейтрализации возникающих при этом ионов H+:
H+ + ОН– = Н2О
![]() Hнейтр (2.10)
Hнейтр (2.10)
Тогда, по закону Гесса, энтальпия ее равна сумме энтальпий этих реакций:
![]()
Следовательно, если известныизмерить энтальпии реакций нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием, то по этим данным можно найти энтальпияю реакции диссоциации слабой кислоты может быть рассчитана по этим данным:
![]()

Рис. 2.1
Общий вид используемой калориметрической установки
Экспериментально тепловые эффекты химических реакций определяют в специальных приборах - калориметрах. Используемая в настоящей работе калориметрическая установка. представлена на рис. 2.1. Она состоит из калориметрического стакана (схематическое изображение калориметрического стакана приведено на рис. 2.2) объемом 400 мл (1),, сделанного по типу сосуда Дьюара, в который помещен сердечник магнитной мешалки (2). Стакан закрывается пластмассовой крышкой (3), имеющей три отверстия: одно - для небольшой воронки (4), второе - для помещения датчика температуры (5), позволяющего регистрировать температуру с точностью до сотых долей градуса, и третье - для нагревателя (6), имеющего точно известное электросопротивление. Отверстия в крышке снабжены зажимами, позволяющими надежно закреплять на необходимой высоте нагреватель и датчик температуры. Высота крепления нагревателя и датчика температурыпоследних определяется темподбирается так, чтобы сердечник магнитной мешалки не задевал за них при работе.
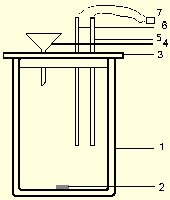
Кроме того, в состав калориметрической установки входит магнитная мешалка, блок питания нагревателя и магнитной мешалки, измерительный преобразователь ЭКСПЕРТ-001-3. Калориметрическая установка может работать в ручном режиме или с компьютером. При работе в ручном режиме значения температуры выдаются на дисплей измерительного преобразователя ЭКСПЕРТ-001-3, записываются и обрабатываются пользователем самостоятельно. ся пользователем самостоятельно. На основании температурных измерений строится график в координатах время - температура, oС.
Рис.2.2 Схематическое изображение калориметрического стакана.
Если калориметрическая установка работает с компьютером, то сбор данных и построение графика осуществляется автоматически.
Примерные графики изменения температуры для экзотермических и эндотермических процессов представлены на рис.2.3 и 2.4.
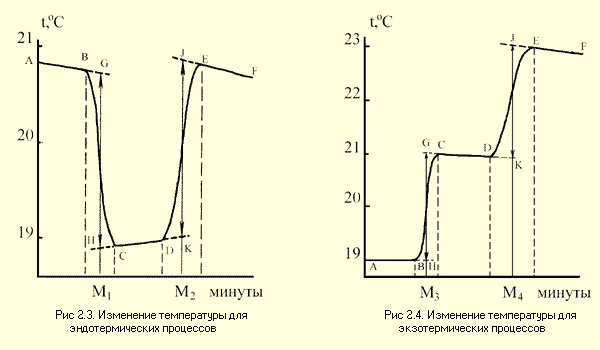
Каждый калориметрический опыт начинают с определения температурного хода калориметрической системы. Для этого в течение нескольких минут измеряют температуру установки (участок АВ на рис. 2.3 и 2.4).
Участок ВС на графиках соответствует
собственно реакции: экзндотермической на рис. 2.3
и экзотермической на рис.2.4. В результате реакции
наблюдается значительное изменение температуры
калориметра ( T1).
Окончание реакции регистрируется после того, как
изменение температураы в в калориметрее
перестанет расти или уменьшаться и её изменение
прекратится или станет медленным и равномерным
(участок CD).
T1).
Окончание реакции регистрируется после того, как
изменение температураы в в калориметрее
перестанет расти или уменьшаться и её изменение
прекратится или станет медленным и равномерным
(участок CD).
Наличие небольшого наклона на графике
температурной зависимости в начальном (АВ) и
конечном (СD) периодах, свидетельствует о том, что
во время опыта имеет место некоторый теплообмен
калориметра с окружающей средой. В расчетах
теплообмен учитывается следующим образом.
Прямая AB экстраполируется вправо, а прямая CD
влево. Интервал времени от B до C делится
пополам и через эту точку проводится
перпендикуляр к оси абсцисс до пересечения его
с экстраполированными участками прямых АВ и СД
(точки H,G). Величина отрезка HG
соответствует изменению температуры
калориметрической системы  T1,
связанному непосредственно с реакцией.
T1,
связанному непосредственно с реакцией.
Тепловой эффект химической реакции может быть рассчитан по формуле
Q = K T1 (2.11)
T1 (2.11)
где К - тепловое значение калориметра,
количество теплоты, которое необходимо для
нагревания калориметра с его содержимым на 1о.
Оно определяется экспериментально, вслед за
выполнением основной части работы. Для этого, с
помощью электрического нагревателя, включенного
на заданное время ![]()
![]() ,
калориметрической системе сообщается точно
известное количество теплоты qэл и
измеряется соответствующее ему изменение
температуры
,
калориметрической системе сообщается точно
известное количество теплоты qэл и
измеряется соответствующее ему изменение
температуры  T2 (участок
DE графиков). Заключительный участок кривой EF
на графике регистрируется после отключения
калориметра от сети.
T2 (участок
DE графиков). Заключительный участок кривой EF
на графике регистрируется после отключения
калориметра от сети.
Количество тепловой энергии qэл,, сообщенное калориметрической системе при нагреве,, вычисляется по формуле Джоуля:
qэл = (U2.Dt)/r (2.12)
где U - напряжение постоянного тока, подаваемоего на нагреватель, В; r -электрическое сопротивление нагревателя, Ом; Dt - время нагрева калориметра, с.
Тепловое значение калориметра:
K = qэл/ T2 (2.13)
T2 (2.13)
Подставив значение K в формулу (2.11), получаем значение теплового эффекта реакции.
Измеренный тепловой эффект следует отнести к 1 моль вещества, для чего необходимо разделить его на число молей (n ) того из участников реакции, который находится в недостатке, тогда:
![]() (2.14)
(2.14)
2.1.1. Вопросы по теме
Увеличивается или уменьшается при этом энтальпия системы? Чему равно изменение энтальпии?
 fHo)
которых больше нуля? меньше нуля? равна нулю?
fHo)
которых больше нуля? меньше нуля? равна нулю?
2.2. Работа 1. Определение теплоты растворения солей
2.2.1. Цель работы
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами.. Экспериментально определить теплоты растворения кристаллогидрата CuSO4• 5H20O и безводной соли CuSO4. Оценить достоверность полученных результатов.
2.2.2.Реактивы
Дистиллированная вода, безводный CuSO4, CuSO4• 5H20O.
2.2.3. Оборудование
Калориметрическая установка, технические весы, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл.
2.2.4. Порядок выполнения эксперимента
Опыт 1. Определение теплоты растворения
кристаллогидрата CuSO4•5H2O.
Начинающим рекомендуется
работать вдвоем. Один студент следит за
показаниями температуры и времени на дисплее
измерительного преобразователя "ЭКСПЕРТ-001-3" и
диктует эти данные второму студенту, который
заносит данные в таблицу 1 в рабочем журнале.)
Взвесьте с точностью до сотых 15 г CuSO4•5H2O.
В калориметрический стакан с помощью мерной колбы налейте 150 мл дистиллированной воды, температура которой должна быть близка к комнатной. Оставьте небольшое количество воды (~ 10 мл.) в колбе.
Опустите в калориметрический стакан сердечник магнитной мешалки и включите в розетку 220 В блок питания.
Нажмите кнопку включения на блоке питания (при этом на блоке питания должна загореться красная лампочка).
Нажмите и удерживайте в течение 2 сек. кнопку "ВКЛ" (рис.2 Приложения) на измерительном преобразователе "ЭКСПЕРТ-001-3" (при этом начнет светиться его жидкокристаллический дисплей). Первая надпись на ж/к дисплее измерительного преобразователя "ЭКСПЕРТ-001-3" показывает уровень зарядки собственных аккумуляторов преобразователя. При величине менее 30 % необходимо зарядить аккумуляторы при помощи сетевого адаптера.
Вращая ручку включения магнитной мешалки, добейтесь оптимальной скорости вращения сердечника магнитной мешалки.
Выберите время работы электрического нагревателя (с) при определении теплового значения калориметра. Для этого на клавиатуре измерительного преобразователе "ЭКСПЕРТ-001-3" нажмите кнопку "Ф2" и далее кнопку "ЧИСЛ". Цифровыми кнопками наберите время работы нагревателя, с. Рекомендуемое время 200 с. После установки времени нагрева два раза нажмите кнопку "ВВОД".
Кнопками "стрелка влево" или "стрелка вправо" выберите режим "ТЕРМОМЕТР".
Начните выполнение опыта, нажав кнопку "ИЗМ". На дисплее появятся данные работы секундомера, работающего в режиме прямого отсчета времени и значения температуры в калориметрическом стакане.
Если установка подключена к компьютеру - одновременно нажмите команду "СТАРТ" в меню программы "Expert001.exe" измерения данных на компьютере.
Определите тепловой ход калориметрической установки. (Участок АВ на рис. 2.3) При работе в ручном режиме записывайте в рабочий журнал в таблицу 1 показания температуры через каждые 30 с. в течение пяти минут. Если измерения показывают, что в течение 5 мин температурные изменения достаточно равномерны и невелики, начинайте эксперимент.
В определенный момент времени, отметив его в рабочем журнале, высыпьте в калориметрический стакан через сухую воронку приготовленную навеску кристаллогидрата сульфата меди CuSO4•5H2O. Оставшейся в мерной колбе водой смойте остатки соли с воронки.
Таблица 1.
| Время измерений, с | 30 | 60 | 90 | 120 | 150 | 180 | 210 | 240 | 270 | 300 |
| Температура измерений, оС |
За счет растворения соли происходит быстрое изменение температуры, поэтому, пока наблюдается рост температуры, фиксирутефиксируйте значения температуры через возможно малые промежутки времени (каждые 5–10 с).
После того, как растворение соли закончится, изменение температуры замедлится и температурный ход снова станет равномерным (участок СD на рис. 2.3), продолжайте измерения температуры через 30 с. еще в течение 5 мин.
Определите тепловое значение калориметрической установки. Для этого нажмите клавишу "Ф2". На дисплее появится время, установленное в начале эксперимента для нагрева калориметрической установки. Секундомер начнет работать в режиме обратного отсчета времени. Записывайте данные измерений температуры в рабочий журнал в таблицу 1 через каждые 30 с. На блоке питания должна загореться вторая лампочка - зеленая. Если зеленая лампочка не горит, значит, нагрев не включен. По окончании нагрева зеленая лампочка на блоке питания гаснет.
После отключения тока нагревателя, рост температуры замедлится, а затем температура начнет медленно падать. Фиксируйте изменение температуры через каждые 30 с еще в течение 5мин..
Нажмите клавишу "ОТКЛ" на клавиатуре измерительного преобразователе "ЭКСПЕРТ-001-3".
Выполните команду "Стоп" на экране монитора компьютера.
Результаты температурных измерений представьте в виде графика. На оси абсцисс нанесите время в секундах, а на оси ординат - показания температуры.
При работе установки с компьютером измерения температуры в зависимости от времени в течении всего эксперимента будут фиксироваться автоматически. В результате на мониторе компьютера появиться график, соответствующий изменению температуры системы в течении всего эксперимента. После его окончания расечатайтераспечатайте полученный график на принтере.
Вопросы и задания:
Опыт 2. Определение теплоты растворения
безводной соли CuSO4
Взвесьте с точностью до 0,01 г ~9 г
безводной соли CuSO4 , предварительно
прокаленной при температуре 400о С в течение
3 ч
Затем проведите опыт по определению теплоты растворения безводной соли CuSO4. Опыт выполняется так же, как и опыт 1.
Результаты температурных измерений представьте в виде графика.
Вопросы и задания:
2.2.5.Что должен предоставить студент преподавателю для сдачи работы:
2.3. Работа 2.Определение теплоты реакции нейтрализации
2.3.1. Цель работы
Получить практические навыки экспериментальной работы с простейшими калориметрическими приборами. Экспериментально определить теплоты нейтрализации сильной кислоты сильным основанием и слабой кислоты сильным основанием. Оценить достоверность полученных результатов.
2.3.2. Реактивы
Дистиллированная вода, 0,4 М HCl, 0,4 M CH3COOH, 6 М KOH.
2.3.3.Оборудование
Калориметрическая установка, мерные колбы на 100 и 50 мл, мерный цилиндр на 20 мл
2.3.4. Порядок выполнения эксперимента
Опыт 3 Определение теплоты нейтрализации сильной кислоты сильным основанием
Определение теплоты нейтрализации сильной кислоты и сильного основания проводите в калориметрической установке, которая была описана выше.
С помощью мерной колбы налейте в калориметрический стакан 150 мл 0,4 М. раствора соляной кислоты. Оставшиеся в колбе следы соляной кислоты смойте в калориметр небольшим количеством дистиллированной воды.
В мерный цилиндр налейте 12 мл 6 М раствора КОН.
Опустите в калориметрический стакан сердечник магнитной мешалки, включите блок питания установки и, вращая ручку регулировки вращения магнитной мешалки, добейтесь оптимальной скорости ее вращения.
Выберите время работы электрического нагревателя, так как это описано в опыте 1. Кнопками "стрелка влево" или "стрелка вправо" выберите режим "ТЕРМОМЕТР" и начните выполнение опыта, нажав кнопку "ИЗМ".
Для того, чтобы результаты измерения фиксировались компьютером, одновременно выполните команду "СТАРТ" в меню программы"Expert001.exe" измерения данных на компьютере.
Определите тепловой ход калориметрической установки (участок АВ на рис. 2.4), записывая в таблицу 1 показания температуры через каждые 30 с. в течение 5 минут.
Влейте через воронку в калориметрический стакан 12 мл 6 М раствора КОН и с этого момента записывайте изменение температуры в калориметрической системе через возможно малые интервалы времени (5-10 с).
После того, как температура стабилизируется, в течение 5 минут фиксируйте изменение температуры через каждые 30 с.
Определите тепловое значение калориметрической установки как это описано в опыте 1 и закончите эксперимент нажатием клавиши "ОТКЛ". Выполните команду "Стоп" на экране монитора компьютера.
Постройте график зависимости температуры калориметрической системы в зависимости от времени или распечатайте его на компьютере.
Вопросы и задания:
Опыт 4. Определение теплоты нейтрализации слабой кислоты сильным основанием
Работу проводите так же, как и в опыте 3, только для реакции нейтрализации возьмите 150 мл 0,4 М раствора уксусной кислоты.
Вопросы и задания:
2.3.5.Что должен представить студент преподавателю для сдачи работы:
Рк +![]() Cl2,г = PCl5,к
Cl2,г = PCl5,к
если РС15 можно получить в две стадии
Чему равна энтальпия образования пентахлорида фосфора?
O2,г + 98,31кДж