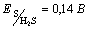|
Рабочая программа по общей и неорганической химии
Учебные материалы по химии для нехимических факультетов
Экзаменационные задачи (ЭЗ)
1.При взаимодействии 0,0300 г некоторого металла с водой выделилось 18,26 мл водорода (750 мм рт. ст., 20°С). Определите металл.
2.Вычислите энтальпию гидратации сульфата натрия по реакции:
Na2SO4(к) + 10H2O(ж) = Na2SO4 10H2O(к), если известно, что энтальпия растворения безводной соли Na2SO4 составляет –2,31 кДж/моль, а энтальпия растворения кристаллогидрата Na2SO4 10H2O(к), если известно, что энтальпия растворения безводной соли Na2SO4 составляет –2,31 кДж/моль, а энтальпия растворения кристаллогидрата Na2SO4 10H2O(к) составляет 79,79 кДж/моль. 10H2O(к) составляет 79,79 кДж/моль.
3.Вычислите энтальпию растворения кристаллогидрата MgSO4 7H2O, если известны энтальпия растворения безводного сульфата магния, равная –91,65 кДж/моль, и энтальпия гидратации MgSO4, то есть энтальпия реакции: 7H2O, если известны энтальпия растворения безводного сульфата магния, равная –91,65 кДж/моль, и энтальпия гидратации MgSO4, то есть энтальпия реакции:
MgSO4(к) + 7H2O(ж) = MgSO4 7H2O(к), равная –103,39 кДж/моль. 7H2O(к), равная –103,39 кДж/моль.
4.Энтальпия растворения кристаллогидрата MgCO3 5H2O составляет –6,78 кДж/моль. Энтальпия гидратации безводной соли по реакции:
MgCO3(к) + 5H2O(ж) = MgCO3 5H2O составляет –6,78 кДж/моль. Энтальпия гидратации безводной соли по реакции:
MgCO3(к) + 5H2O(ж) = MgCO3 5H2O(к),
составляет –42,02 кДж/моль. Вычислите энтальпию растворения безводного карбоната магния. 5H2O(к),
составляет –42,02 кДж/моль. Вычислите энтальпию растворения безводного карбоната магния.
5.Константа равновесия реакции: CaCO3(к) - CaO(к) + CO2(г) при 600oС равна 5•10–3. Рассчитайте константу равновесия при 1000oС, если энтальпия реакции равна 178,2 кДж/моль. В какую сторону сместиться равновесие реакции при повышении температуры?
Константы равновесия реакции: Fe3O4(к) + 4C(к) - 3Fe(к) + 4CO(г) при 600oС и 800oС равны соответственно 2,02•10–4 и 6,85•103. Экзотермическая или эндотермическая эта реакция. В какую сторону сместится равновесие данной реакции при повышении температуры? Рассчитайте по приведенным данным  rS и rS и  rН. rН.
7.Константы равновесия реакции: C(к) + CO2(г)- 2CO(г) при 400oС, 600oС и 800oС равны соответственно 6,0•10-5, 7,0•10–2 и 5,95. Рассчитайте по приведенным данным  rS и rS и  rН. . В какую сторону сместится равновесие реакции при повышении температуры? rН. . В какую сторону сместится равновесие реакции при повышении температуры?
8. Вычислите стандартную энтальпию образования аммиака по тепловым эффектам реакций:
2H2 + O2 = 2Н2Oж  rН1 = –571,6 кДж rН1 = –571,6 кДж
4NH3 + 3O2= 2N2 + 6H2Oж  rН2 = –1530 кДж rН2 = –1530 кДж
9.Рассчитайте энтальпию реакции Салмаз Сграфит, если известно, что энтальпии реакций сгорания графита и алмаза соответственно равны
–393,5 кДж и –395,3 кДж. Сграфит, если известно, что энтальпии реакций сгорания графита и алмаза соответственно равны
–393,5 кДж и –395,3 кДж.
10.Определите температуру, при которой возможно восстановление водородом оксида железа (III) до свободного металла при стандартных состояниях веществ. Зависимостью  rH и rH и rS от температуры можно пренебречь. rS от температуры можно пренебречь.
Вещество |
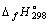 кДж/моль кДж/моль |
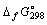 кДж/моль кДж/моль |
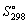 кДж/K.моль кДж/K.моль |
Fe2O3 |
–822,2 |
–740,3 |
87,4 |
H2(г) |
0 |
0 |
130,5 |
Fe(к) |
0 |
0 |
27,2 |
H2O (г) |
–241,8 |
228,6 |
188,7 |
11.Определите константу равновесия реакции
N2O4(г) 2NO2(г) при 400 K 2NO2(г) при 400 K
Вещество |
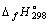 кДж/моль кДж/моль |
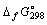 кДж/моль кДж/моль |
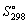 кДж/K.моль кДж/K.моль |
N2O4( г ) |
9,6 |
98,4 |
303,8 |
NO2(г) |
33,4 |
51,5 |
240,2 |
12.В каком направлении будет протекать процесс 2NO2(г) 2NO(г) + O2(г) при 500 K и стандартных состояниях всех веществ? Рассчитайте константу равновесия данного процесса. 2NO(г) + O2(г) при 500 K и стандартных состояниях всех веществ? Рассчитайте константу равновесия данного процесса.
Вещество |
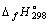 кДж/моль кДж/моль |
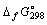 кДж/моль кДж/моль |
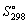 кДж/K.моль кДж/K.моль |
NO(г) |
90,2 |
86,6 |
210,6 |
NO2(г) |
33,4 |
51,5 |
240,2 |
O2(г) |
0 |
0 |
205,0 |
13.При увеличении концентрации вещества А в 1,6 раза скорость реакции возросла в 2,9 раза. Каков порядок реакции по веществу А?
14.Для реакции 2NО + 2H2 = N2 + H2O при 1000o получены следующие экспериментальные данные:
С(NО), моль/л |
С(H2), моль/л |
r, моль/л мин
|
0,012 |
0,002 |
0,20 |
0,012 |
0,004 |
0,40 |
0,02 |
0,012 |
0,30 |
15.Во сколько раз возрастет скорость реакции, имеющей энергию активации 190 кДж/моль при увеличении температуры от 120° до 180°.
16. Разложение N2O5(г)  2N2O4(г) + 1/2 O2(г) является реакцией I порядка. Константы скорости реакции при 293 K и 323 K равны 1,72 2N2O4(г) + 1/2 O2(г) является реакцией I порядка. Константы скорости реакции при 293 K и 323 K равны 1,72 10–5 и 7,59 10–5 и 7,59 10–4с–1. Напишите кинетическое уравнение реакции и рассчитайте ее энергию активации. 10–4с–1. Напишите кинетическое уравнение реакции и рассчитайте ее энергию активации.
17.Реакция термического разложения этана является реакцией I порядка. При 823 K константа скорости равна 2,5 105 с–1, при 903 K—141,5 105 с–1, при 903 K—141,5 105 с–1. Рассчитайте энергию активации данной реакции и предэкспоненциальный множитель. 105 с–1. Рассчитайте энергию активации данной реакции и предэкспоненциальный множитель.
18.Реакция А(г) + B(г) = D(г) имеет I порядок по компоненту А и I порядок по компоненту В. Начальная концентрация компонентов А и В соответственно равны 0,04 и 0,06 моль/л соответственно. Константа скорости при 25°С 0,3 л/моль.с. Запишите кинетическое уравнение данной реакции, найдите ее энергию активации и константу скорости при температуре 45°С. Предэкспоненциальный множитель равен 2,7 105. 105.
19. Во сколько раз изменится скорость реакции при 400 K? Если катализатор изменит энергию активации от 120 до 50 кДж.
20.Рассчитайте ионную силу и активность иона Н+ в 1 л раствора, содержащем 0,005 молей HCl и 0,001 молей CaCl2.
21.В 0,05 М растворе HCN степень диссоциации равна 1,26 10–4. Найдите рН этого раствора и константу диссоциации HCN. 10–4. Найдите рН этого раствора и константу диссоциации HCN.
22. Рассчитайте, как изменится значение рН 0,1 М раствора HCN при разбавлении в 10 раз (Kд(HCN) = 6,16 10–10). 10–10).
23.Смешали 100 мл 0,01 М раствора уксусной кислоты и 20 мл 0,05 М раствора соляной кислоты. Рассчитайте степень диссоциации уксусной кислоты в этом растворе (Kд(СH3COOH) = 1,8 10–5). 10–5).
24.Сколько г ацетата натрия нужно растворить в 1 л 0,1 М раствора уксусной кислоты, чтобы получить раствор с рН равным 5. Изменением объема раствора можно пренебречь.
25.Рассчитайте рН раствора, содержащего в 1 л 0,05 моль NH3 и 0,025 моль NH4Cl.
26.Найдите концентрацию ионов Br– в насыщенном растворе HgBr2, если его ПР = 6,2 10–20. 10–20.
27.Сколько г кристаллического PbCl2 можно растворить в 0,1 М растворе NaCl (ПР(PbCl2) = 1,7 10–5). 10–5).
28.Определите, выпадет ли осадок при сливании 300 мл 0,001 М раствора Sr(NO3)2 и 600 мл 0,0001 М раствора Na2SO4 (ПР(SrSO4) = 3,44 10–7). 10–7).
29.Рассчитайте рН насыщенного раствора Ca(OH)2 и энергию Гиббса реакции растворения Ca(OH)2 в воде (ПР(Ca(OH)2) = 5,02 10–6). 10–6).
30. Рассчитайте степень гидролиза по первой ступени и рН 10–3 М раствора Al2(SO4)3 (Kд3(Al(OH)3) = 1,26 10–9). 10–9).
31.Учитывая только I ступень гидролиза, рассчитайте концентрацию раствора AlCl3 рН которого равен 3,5 (Kд3(Al(OH)3) = 1,26 10–9). 10–9).
32. Рассчитайте концентрацию водного раствора KCN, если его рН равен 10 (Kд(HCN) = 6,16 10–10). 10–10).
33.Рассчитайте эдс гальванического элемента, состоящего из 2 цинковых электродов, если концентрации соли составляют 0,1 М у одного электрода и 10–4М у другого электрода.
34.Рассчитайте константу равновесия реакции: Ti3+ + Mg  Mg2+ + Ti, если Mg2+ + Ti, если 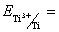 –1,37 В, а –1,37 В, а 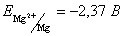 . .
35.Рассчитайте константу равновесия и эдс реакции:
Pb2+ + Zn  Zn2++ Pb при концентрациях ионов Zn2+ и Pb2+ 0,01 моль/л. Zn2++ Pb при концентрациях ионов Zn2+ и Pb2+ 0,01 моль/л.
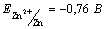 , , 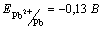
36.Рассчитайте электродный потенциал полуреакции
ClO4- +8H+ +8e = Cl– + 4H2O при рН равном 3 и концентрациях ионов ClO4- 0,01 моль/л и Cl– 0,005 моль/л. Стандартный электродный потенциал
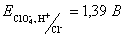 . .
37. Рассчитайте концентрацию ионов Mn2+, если электродный потенциал полуреакции MnO4– +8H+ +5e = Mn2+ + 4H2O составляет 1,261 В, рН = 3, а концентрация ионов MnO4– 0,01 моль/л.
38. Смешали 2 М раствор K2Cr2O7, 0,4 М раствор CrCl3, 2 М раствор HCl и 0,2 М раствор Cl2. Напишите уравнение реакции и рассчитайте ее эдс
, 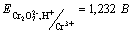 . .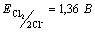
39.Вычислите электродный потенциал серебра в насыщенном растворе Ag2CrO4. 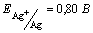 , ПР(Ag2CrO4) = 1,12 , ПР(Ag2CrO4) = 1,12 10–12. 10–12.
40.
Вычислите ПР Ag2S при 298 K, если электродный потенциал серебра в насыщенном растворе Ag2S равен–0,65 В.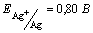 . .
41.Выпадет ли осадок, если к 10 мл 0,001 М раствора нитрата свинца прилить 20 мл 0,0002 М раствора сульфида натрия? Для расчета воспользуйтесь термодинамическими данными .
| Вещество или ион |
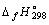 кДж/моль кДж/моль |
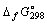 кДж/моль кДж/моль |
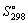 кДж/K?моль кДж/K?моль |
PbS |
|
|
|
Pb 2+ (р) |
–0,9 |
–24,4 |
13 , 0 |
| S2–(р) |
32,6 |
85,40 |
–14,5 |
42.Определите константу равновесия реакции:
2FeCl3 + H2S  FeCl2 + S FeCl2 + S + H2O
и сделайте вывод, пойдет ли реакция в стандартных условиях. + H2O
и сделайте вывод, пойдет ли реакция в стандартных условиях. 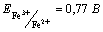 , , 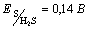
43.Вычислите концентрации ионов Cl-, [Co(NH3)6]3+, [Co(NH3)5H2O]3+ в 0,01 М растворе соли [Co(NH3)6]Cl3. Константа устойчивости b1([Co(NH3)6]3+) по первой ступени равна 0,25.105.
44.При какой концентрации ионов S2– выпадет осадок из 0,001 М раствора соли [Cd(NH3)6]Cl2, содержащего аммиак в концентрации 2 моль/л .b([Cd(NH3)6]2+) = 3,98.104; ПР(CdS) = 3,6.10–19
45.Константа устойчивости комплексного иона [Cd(CN)4]2+ составляет 7,1.1018. Вычислите концентрацию ионов S2–, при которой начнется выпадение осадка CdS из 0,05 М раствора K2[Cd(CN)4], содержащего KCN в концентрации 0,1 моль/л. ПР(CdS) = 3,6.10–19
46.Определите константу устойчивости комплексного иона [Hg(CN)4]2–, если известно:
Hg2+ + 2e = Hg E° = 0,85 В
[Hg(CN)4]2– + 2e = Hg + 4CN– E° = –0,37 В
Число Фарадея F = 96500 Кл/моль.
47.Определите стандартный электродный потенциал реакции:
[Ag(CN)2]– + e = Ag + 2CN– , если известен стандартный электродный потенциал реакции:
Ag+ + e = Ag E° = 0,80 В
и константа устойчивости комплексного иона [Ag(CN)2]– b = 7,1.1019.
Число Фарадея F = 96500 Кл/моль.
48.Определите стандартный электродный потенциал реакции:
Zn2+ + 2e = Zn,
если известен стандартный электродный потенциал реакции:
[Zn(CN)4]– + 2e = Zn + 4CN– E° = –1,26 В
и константа устойчивости комплексного иона [Zn(CN)4]2– b = 7,7.1016.
Число Фарадея F = 96500 Кл/моль.
|

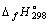 кДж/моль
кДж/моль 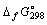 кДж/моль
кДж/моль 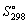 кДж/K.моль
кДж/K.моль 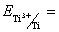 –1,37 В, а
–1,37 В, а 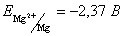 .
. 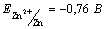 ,
, 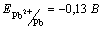
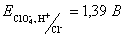 .
.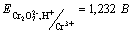 .
.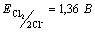
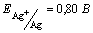 , ПР(Ag2CrO4) = 1,12
, ПР(Ag2CrO4) = 1,12 кДж/моль
кДж/моль 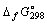 кДж/моль
кДж/моль 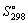 кДж/K?моль
кДж/K?моль 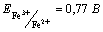 ,
,