|
В.В.Загорский
Трудные темы школьного курса химии
Химическая связь и строение молекул
Урок 2 . Строение кристаллов и молекул
Точно определить структуру вещества, т.е. расположение атомов в нем, удалось впервые для кристаллических веществ с преимущественно ионной связью.
Ставшие уже привычными носителями информации лазерные диски переливаются на свету всеми цветами радуги. Это – прямое наблюдение дифракционной картины на объекте, у которого расстояние между бороздками на отражающей поверхности сопоставимо с длиной волны падающего света [ ]]. ]].
После открытия рентгеновских лучей в 1895 году немецкий физик Макс Лауэ [ ] предположил, что для излучения с длиной волны в несколько тысяч раз короче волн видимого света дифракционную картину можно будет наблюдать на правильных кристаллах, которые, по предположению, должны состоять из расположенных равномерными рядами атомов. Первые же эксперименты, выполненные на кристаллах медного купороса, подтвердили это предположение [ 1]. ] предположил, что для излучения с длиной волны в несколько тысяч раз короче волн видимого света дифракционную картину можно будет наблюдать на правильных кристаллах, которые, по предположению, должны состоять из расположенных равномерными рядами атомов. Первые же эксперименты, выполненные на кристаллах медного купороса, подтвердили это предположение [ 1].
В 1912 г Лоуренс Брэгг определил по дифракционной картине, полученной на фотопластинке от рентгеновских лучей, структуру сфалерита (кубическая форма сульфида цинка) [ (фото) (фото)  (модель) ]. Его отец Уильям Брэгг [ (модель) ]. Его отец Уильям Брэгг [ ] изготовил первый рентгеновский спектрометр и в течение года Брэгги [ ] изготовил первый рентгеновский спектрометр и в течение года Брэгги [ ] определили строение около 20 разных кристаллов. ] определили строение около 20 разных кристаллов.
Именно Брэгги показали, что кристаллы, например, хлорида натрия состоят не из молекул NaCl , как предполагалось ранее, а из расположенных определенным образом ионов натрия и ионов хлора. Таким образом, любой ионный кристалл можно считать гигантской молекулой, а выражающий его состав символ NaCl с относительной массой 58,5 надо называть не молекулой, а формульной единицей. Это относится к любым ионным кристаллам.
В настоящее время существуют различные виды рентгеноструктурного анализа, позволяющие изучать не только ионные монокристаллы, но и поликристаллические образцы, а также кристаллы ковалентных соединений [ ]. ].
Одновременно с развитием экспериментальных методов исследования строения вещества в первой половине XX века появились теории, позволяющие предсказывать химические свойства элементов и структуры образуемых ими соединений.
В 1913 г. Американский химик Гилберт Льюис [ ] предложил термин "металлическая связь" для объяснения структуры и свойств металлов. А в 1916 г. он же развил теорию кубического атома (правило октета) и предложил точечные формулы для атомов (электроны внешнего уровня обозначаются точками вокруг символа элемента). ] предложил термин "металлическая связь" для объяснения структуры и свойств металлов. А в 1916 г. он же развил теорию кубического атома (правило октета) и предложил точечные формулы для атомов (электроны внешнего уровня обозначаются точками вокруг символа элемента).
Обозначения «по Льюису» не являются теорией в строгом смысле, скорее это удачные методические приемы. Точечные формулы широко используются в преподавании химии до сих пор; менее известны сейчас «кубические атомы», позволяющие очень наглядно показать взаимодействие между элементами главных подгрупп 2-го и 3-го периодов:
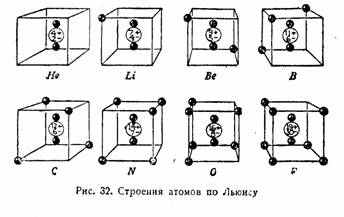
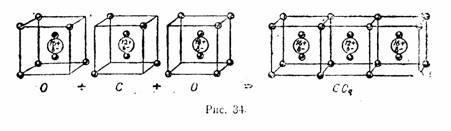
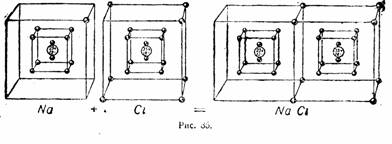
"Кубические атомы" по Льюису. Иллюстрации из "Рабочей книги по технической химии" В.В.Терновского под ред. В.Н.Верховского, 1932 г.
Разумеется, эти модели не могут быть универсальными, как и пропагандируемые в последнее время модели атомов Снельсона, представляющие атом в виде системы упругих колец – орбит электронов [ ]. ].
Для повышения уровня наглядности в преподавании (принцип наглядности в педагогику массовой школы ввел еще Ян Коменский в XVII веке [ ]) можно пользоваться любыми моделями при условии обязательного напоминания школьникам и студентам о том, что данная модель относится к реальности как карта местности к самой местности. ]) можно пользоваться любыми моделями при условии обязательного напоминания школьникам и студентам о том, что данная модель относится к реальности как карта местности к самой местности.
Теория гибридизации
До сих пор школьников и студентов заставляют учить «правила гибридизации» и строить структуры молекул на основании «формы гибридных орбиталей». Однако следует помнить, что понятие «гибридизация» Лайнус Полинг [ ] ввел в практику преподавания как модельное представление для объяснения симметричной структуры связей атома углерода. Для объяснения геометрии соединений с кратными связями и относительной длины таких связей у углерода сам Л.Полинг пользовался системой тетраэдров и шаростержневыми моделями [ 2]: ] ввел в практику преподавания как модельное представление для объяснения симметричной структуры связей атома углерода. Для объяснения геометрии соединений с кратными связями и относительной длины таких связей у углерода сам Л.Полинг пользовался системой тетраэдров и шаростержневыми моделями [ 2]:
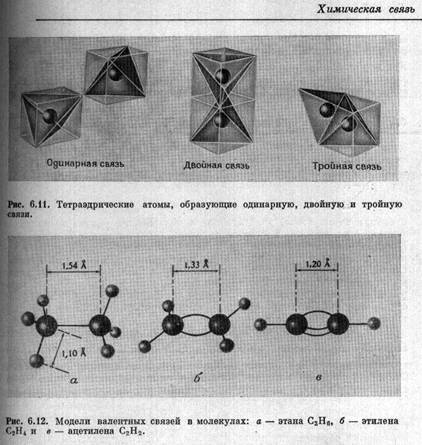
Об относительности любых моделей при описании химической связи подробно и наглядно сказано в статье А.В.Шевелькова [ ]. Например, про «гибридизацию» полезно помнить, что: ]. Например, про «гибридизацию» полезно помнить, что:
- Только у атомов элементов 2-го периода смешивание орбиталей реально.
- Гибридизация с помощью математических операций помогает представить ковалентные связи направленными.
- Реальная гибридизация как механизм, а не как модель, может проявляться только у элементов 2-го периода.
Определение формы молекул по Гиллеспи Р., Харгиттаи И.
Одной из наиболее наглядных и удобных для преподавания является модель строения молекул, развитая Роналдом Гиллеспи и Иштваном Харгиттаи [ 3].
В 1940 г. Невил Сиджвик [ ] и Пауэлл предложили модель отталкивания электронных пар, которая впоследствии была развита Гиллеспи. Основные идеи этого подхода, приложимого только к соединениям непереходных элементов , сводятся к следующему [ ] и Пауэлл предложили модель отталкивания электронных пар, которая впоследствии была развита Гиллеспи. Основные идеи этого подхода, приложимого только к соединениям непереходных элементов , сводятся к следующему [ ]: ]:
- Конфигурация связей, образуемых многовалентным атомом, обусловлена числом электронных пар его валентной оболочки, существующих как на связывающих, так и на несвязывающих МО.
- Ориентация облаков плотности электронных пар, описываемых валентными орбиталями, определяется их максимальным взаимным отталкиванием.
Решение задачи о размещении максимально удаленных друг от друга точек, символизирующих центры тяжести облаков электронных пар, при числе точек от 2 до 12 приводит к возможным конфигурациям связей, перечисленным в таблице. Соответственно, легко представить геометрию молекул, имеющих такое расположение электронных пар.
Конфигурация связей центрального атома А в зависимости от числа
электронных пар q на его валентных орбиталях
q |
Конфигурация |
q |
Конфигурация |
2 |
Линейная или уголковая |
8 |
Квадратная антипризма |
3 |
Равносторонний треугольник |
9 |
Треугольная призма с тремя дополнительными вершинами |
4 |
Тетраэдр |
10 |
Квадратная антипризма с двумя дополнительными вершинами |
5 |
Тригональная бипирамида, квадратная пирамида |
11 |
Икосаэдр без одной вершины |
6 |
Октаэдр |
12 |
Икосаэдр |
7 |
Октаэдр с дополнительной вершиной |
|
|
Существуют простые правила , делающие модель Гиллеспи весьма эффективной:
а) Неподеленная электронная пара занимает больший объем, чем связывающая пара ординарной связи.
б) Сила отталкивания электронных пар в данной валентной оболочке понижается в следующем порядке: Е-Е, Е-Х, Х-Х (Е - неподеленная электронная пара, Х- связывающая электронная пара).
в) Объем связывающей электронной пары уменьшается с увеличением электроотрицательности лиганда.
г) Электронные пары двойной или тройной связей занимают больший объем, чем электронная пара ординарной связи.
Модель отталкивания электронных пар дает приближенный качественный метод предсказания структуры молекул.
Пример: определить форму молекулы Н2О
Сначала определяем число электронов вокруг центрального атома. У кислорода 6 своих электронов, еще 2 предоставляют ему 2 атома водорода. Всего вокруг кислорода 8 электронов или 4 электронные пары. Эти пары расположены в пространстве максимально симметрично – считаем, что все они одновременно притягиваются к общему центру (кислород) и взаимно отталкиваются. Фигура, которую могут по таким законам образовать 4 шара – тетраэдр . На двух вершинах этого тетраэдра находятся ядра водорода, и между этими двумя вершинами угол может отличаться от тетраэдрического. Вывод: форма молекулы Н2 О угловая , атомы водорода на концах угла.
Пример: определить форму молекулы SF4
Сначала определяем число электронов вокруг центрального атома. У серы 6 своих электронов, на образование связей с 4 атомами фтора фтор “предоставляет” еще 4 электрона для получения электронных пар. Всего вокруг центрального атома серы 10 электронов или 5 пар. Максимально симметричная фигура – тригональная бипирамида (два тетраэдра с общей гранью). Фторы располагаются у двух вершин центрального треугольнаки и на противостоящих вершинах “состыкованных” пирамид. Форма молекулы SF4 – “качели”, “ручной пулемет на ножках” или дисфеноид .
Демонстрация: Теорию Гиллеспи удобно демонстрировать на простых моделях. Это стянутые тонкой резинкой круглые воздушные шарики, либо просверленные насквозь (чтобы удобнее продевать резинку) шарики от набора шаростержневых моделей молекул.
Если мы притягиваем резинками к общему центру («атому») четыре шарика, обозначающих 4 электронные пары, то они обязательно образуют наиболее устойчивую фигуру – тетраэдр. Из пяти шариков сама собой получается тригональная пирамида и т.д. При изготовлении моделей нужно избегать узелков в центре между шариками – чтобы не было «отталкивания от ядра», искажающего симметричные структуры.
1. Полинг Л. Общая химия, М.: Мир, 1974, 846 с., стр. 70
2. Полинг Л. Общая химия, М.: Мир, 1974, (амер. изд. 1970)846 с., стр. 151
3. Гиллеспи Роналд, Харгиттаи Иштван Модель отталкивания электронных пар валентной оболочки и строение молекул: Пер. с. англ. – М.: Мир, 1992. – 296 с.
|




