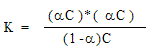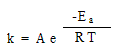|
В.В.Загорский
Трудные темы школьного курса химии
Элементы химической термодинамики и кинетики
Урок 5 . Решение задач
Тест по элементарной термодинамике и кинетике
(средняя школа и 1 курс)
В каждом задании выберите правильные ответы
1. В ходе самопроизвольной химической реакции теплота:
1) всегда выделяется;
2) всегда поглощается;
3) может выделяться или поглощаться;
4) может не выделяться и не поглощаться; 5) не знаю
2. С выделением тепла протекает химическая реакция, описываемая уравнением
1) CaO + H2O - Q = Ca(OH)2
2) CaCO 3 = CaO + CO2 - Q
3) 2 CH4 + Q = C2H2 + 3 H2
4) 2 NH3 = N2 + 3 H2 - Q
5) не знаю
3. При стандартных условиях тепловой эффект реакции:
N2 + 3 H2= 2 NH3 равен +92 кДж
Стандартная энтальпия образования аммиака равна:
1) - 92 кДж/моль; 2) - 184 кДж/моль; 3) - 46 кДж/моль; 4) + 46 кДж/моль; 5) не знаю
4. Выберите неверные утверждения. Тепловой эффект реакции
1) не зависит от направления реакции;
2) определяется состоянием исходных веществ;
3) определяется состоянием продуктов реакции;
4) зависит от числа промежуточных стадий реакции;
5) не знаю
5. Реакция хлорида натрия с нитратом серебра в растворе протекает до конца, потому что:
1) исходные вещества относятся к солям;
2) хлорид серебра не растворяется в воде;
3) ионы натрия и серебра имеют одинаковый положительный заряд;
4) исходные вещества – сильные электролиты;
5) не знаю
6. Какие факторы могут сместить равновесие процесса вправо:
CH4 + H2Oпар  CO + 3H2 - Q CO + 3H2 - Q
1) повышение давления; 2) повышение температуры;
3) использование катализатора; 4) понижение давления; 5) не знаю
7. Для увеличения выхода аммиака по уравнению реакции
N2 + 3H2 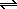 2 NH3 + Q необходимо одновременно: 2 NH3 + Q необходимо одновременно:
1) повысить температуру, понизить давление;
2) повысить давление, понизить температуру;
3) повысить давление и температуру;
4) понизить давление и температуру;
5) не знаю
8. Изменение давления смещает равновесие в системе:
1) N2 + O2 2NO 2) S + O2 2NO 2) S + O2 SO2 SO2
3) 2H2 + O2  2H2O 4) CO2 2H2O 4) CO2  C + O2 C + O2
5) не знаю
9. Во сколько раз изменится скорость элементарной реакции 2А + В = 2 С, если концентрацию вещества А уменьшить в 2 раза?
1) увеличится в 4 раза; 2) уменьшится в 2 раза;
3) уменьшится в 4 раза; 4) увеличится в 2 раза; 5) не знаю
10. Скорость реакции, протекающей по уравнению H2 + I2 = 2HI , не зависит от
1) общего объема газовой смеси 2) давления водорода
3) температуры газовой смеси 4) давления иода; 5) не знаю
11. Правило Вант-Гоффа выражается так:
1) v = 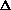 с/ с/ 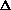 t; t;
2) v = k[A] a [B] b ;
3) 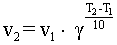 ; ;
4) pV = n RT;
5) не знаю
ОТВЕТЫ
Вводный тест по общей химии
(средняя школа и 1 курс)
1. 3) может выделяться или поглощаться; 4) может не выделяться и не поглощаться
2. 1) CaO + H2O - Q = Ca(OH)2
3. 3) - 46 кДж/моль
4. 1) не зависит от направления реакции; 4) зависит от числа промежуточных стадий реакции
5. 2) хлорид серебра не растворяется в воде
6. 2) повышение температуры; 4) понижение давления
7. 2) повысить давление, понизить температуру
8. 3) 2H2 + O2  2H2O 2H2O
9. 3) уменьшится в 4 раза
10. 1) общего объема газовой смеси
11. 3) 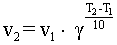
Задачи вступительных экзаменов МГУ на тему "Равновесие" [  ] ]
Обычно задачи на эту тему оказываются трудными, потому что для их решения конкретные знания химии сами по себе не помогают; но от абитуриента требуется “математическое видение” проблемы и перевод химических величин (моль) в достаточно простые алгебраические выражения. Не все готовы к тому, что на экзамене по химии им придется не вспоминать вызубренное, а мыслить “по математически”.
Приведенные ниже задачи взяты из сборника: Кузьменко Н.Е., Еремин В.В., Чуранов С.С., Сборник конкурсных задач по химии – М.: Экзамен, 2001 – 576 с. ; в [квадратных скобках] указаны страницы, где находятся условия и решения (ответы).
1. (Химфак-97, вариант ПО-97-1[стр.290])
Один моль аммиака поместили в сосуд объемом 20 л и нагрели до 600 0 C. Давление в сосуде оказалось равным 435 кПа. Рассчитайте степень разложения аммиака.
2. (Химфак-весна-98; ВКНМ-98; Химфак-заочн.-99, вариант СО-98-1 [стр. 93])
Смешали по три моля веществ А, В, С. После установления равновесия А + В = 2С в системе обнаружили 5 молей вещества С. Рассчитайте константу равновесия. Определите равновесный состав смеси (в мольных %), полученной смешением веществ А, В, С в мольном соотношении 3:2:1 при той же температуре.
3. (Химфак-весна-93; Химфак-заочн.-94; Химфак-весна-94; ВКНМ-96, вариант 171-94-2 [стр. 55]. Это одна из самых трудных конкурсных задач Химфака МГУ)
Имеется смесь азота и водорода, которая на 5% легче гелия. После пропускания смеси над нагретым катализатором образовался аммиак, в результате чего смесь стала тяжелее гелия при тех же условиях. Рассчитайте область допустимых значений для выхода реакции.
4. (Химфак-весна-93, вариант 171-93-4 [стр. 49])
Уксусную кислоту массой 25 г растворяют в воде, и объем раствора доводят до 1 л. Определите концентрацию ионов H + в полученном растворе, если константа диссоциации уксусной кислоты равна 1,8*10 –5 . Изменением концентрации кислоты при диссоциации пренебречь.
Задачи “Равновесие”. Решения
1. [Сборник, стр. 560]
Количество (моль) газов после реакции: PV/RT = 435*20/(8,31*873) = 1,20 моль
Если разложилось х моль аммиака, то схема разложения:
Осталось NH3 (1-х); получилось N2 (х/2) + H2 (3х/2)
Из уравнения: 1,20 моль = (1-x) + x/2 + 3x/2 = 1+x
получим x = 0,2 моль.
Ответ: Степень разложения аммиака 20%
2. [Сборник, стр. 412]
Соотношение количеств веществ (моль) соответствует соотношению их коэффициентов в уравнении. Если С стало на 2 моля больше (5 из 3), то количества А и В уменьшились на 1 моль каждое. В результате при установлении равновесия стало 5 моль С, по 2 моль А и В.
Константа равновесия:
К = [С] 2 / ([А][В]) = 25/2*2 = 6,25
Второй случай:
Мольное соотношение то же; примем за х число молей прореагировавших А и В (они одинаковы):
К = (1+2х) 2 /{(3-х)(2-х)} = 6,25
х = 1,115
Ответ: Мольные доли веществ в равновесной смеси:
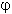 (А) = (3-1,115)/6 = 0,314 ; (А) = (3-1,115)/6 = 0,314 ;
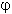 (В) = (2-1,115)/6 = 0,148 ; (В) = (2-1,115)/6 = 0,148 ;
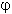 (С)= 0,538 (С)= 0,538
3. [Сборник, стр. 371]
Пусть в исходной смеси было X моль N2 и Y моль H2 .
Средняя молярная масса смеси на 5% легче гелия или 0,95*4:
М ср. = (28X + 2Y)/(X + Y) = 0,95*4 = 3,8 ;
Тогда Y = 13,44X
Реакция: N2 + 3 H2 = 2 NH3
Если прореагировало a моль N2 и 3a моль H2, получим после реакции:
(X - a) + (Y - 3a) + 2a = 14,44X - 2a ( моль )
Масса смеси после реакции (выразим через Х, так как Y = 13,44X):
28X + 2Y = 54,9 X г
Средняя молярная масса смеси после реакции > 4 г/моль (по условию):
Мср. = 54,9X/(14,44X - 2a) > 4 ;
тогда : a > 0,3575X
Выход реакции – это доля прореагировавшего азота (коэффицент в реакции 1):
a/X;
Смесь станет тяжелее гелия (М ср. > 4) при a/X > 35,75%
Ответ: выход аммиака больше 35,75%
4. [Сборник, стр. 361]
Уксусная кислота – слабая, и концентрация ионов H + в ее растворе не равна концентрации кислоты, как в случае разбавленных растворов сильных кислот.
Диссоциацию уксусной кислоты можно упрощенно записать в виде равновесия: CH33COOH « H + + CH3COO –
Константа равновесия процесса:
K = {[H + ]*[CH33COO – ]}/[CH33COOH]
В 1л содержится 25/60 = 0,417 моль кислоты; обозначим a степень ее диссоциации, равную отношению продиссоциировавших молекул к общему числу молекул в растворе. Если концентрация кислоты С, то получится a С моль ионов H + и столько же ионов CH33COO – . В растворе останется (1- a )С моль CH33COOH.
Тогда константа диссоциации:
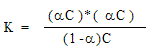
Для дальнейших расчетов можно сделать важное допущение: при малой константе диссоциации можно пренебречь величиной a по сравнению с 1:
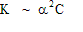
В курсе общей химии такое преобразование иногда называют “закон разбавления Оствальда”.
Тогда:
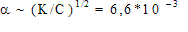
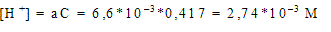
Ответ: 2,74*10 –3 М
Трудная задача вступительных экзаменов МГУ на тему «Кинетика»
Пример: Факультет фундаментальной медицины МГУ, 2002 год, вариант М-2002-1:
Две реакции протекают с одинаковой скоростью (w1 = w2 ) при 200С, температурный коэффициент скорости первой реакции равен 6, второй – 3. Как будут относиться скорости реакций w2 /w1 , если реакции проводить при 600С?
Решение:
Строго говоря, правильный ответ на такой вопрос: “Не знаю”.
Разница в 400С слишком велика, чтобы считать g постоянным, а сам температурный коэффициент зависит от температуры в соответствии с уравнением Аррениуса:
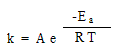
(см. задачи из того же сборника “Письменный экзамен по химии МГУ-2002” – вариант C-2002-1). Эта зависимость выражается в том, что для двух разных температур даже при постоянстве энергии активации соотношение скоростей (констант скоростей) включает произведение абсолютных температур, а не только их разность:
k1 /k2 = [Aexp(-E A /RT1 )]/[ Aexp(-E A/RT2 )] = exp(E A /R)(1/T2 - 1/T1 ) =
= exp(E A /R)[(T1 - T2)/T2T1 ]
Из формулы получается, что при одинаковой разности в 100 разница скоростей будет больше при более низких температурах (будет меньше знаменатель выражения, находящегося в степени).
Задача, где был проведен такой анализ, предлагалась абитуриентам Химического факультета МГУ на заочном этапе экзаменов в 1994 г. Следовательно, для корректности задачи из варианта М-2002-1 в условии обязательно должно быть оговорено, что g можно считать постоянным.
Авторский ответ: 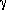 1 = 6; 1 = 6; 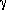 2 = 3; DT = 60 - 20 = 40 0 2 = 3; DT = 60 - 20 = 40 0
Тогда отношение скоростей: ( 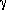 2DT/10 )/ ( 2DT/10 )/ ( 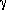 1 D T/10 ) = 3 4 /6 4 = 1/16 1 D T/10 ) = 3 4 /6 4 = 1/16
|