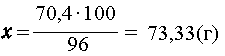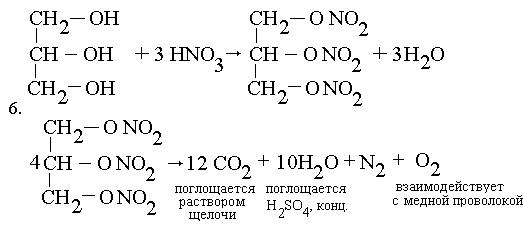Сорокин В.В.,
Загорский В.В., Свитанько И.В.Задачи химических
олимпиад.
§ 3. Решение задач с составлением двух и более пропорций.
3.1.Расчеты по уравнениям нескольких последовательных реакций
В задачах, представленных в настоящем
параграфе, требуется составить не одну, а две или
более пропорций. Обычно учащиеся хорошо
справляются с задачами, в которых требуется
составить одну пропорцию, они могут
преобразовывать данные условия в явный вид, но
часто теряются и испытывают трудности, когда
исходное вещество или продукт реакции задаются
так, что предварительно надо просчитать еще одну
или несколько пропорций.
Рассмотрим пример, когда условие задачи
сформулировано в общем виде. "Из вещества Е
получают А, которое реагирует с веществом В с
образованием продуктов С и D. Дается т(Е) - масса
вещества Е. Требуется определить т (С) -массу
вещества С".
Следует отметить, что, как и ранее, все вещества
А-Е известны. Составим схемы превращений и
напишем уравнения реакций:
eE = kA, (1)
aA+bE = cC + dD. (2)
По уравнению (1) составим пропорцию:
| из еМ(Е) г вещества Е образуется kM(A)
г вещества А, |
| из т(Е) г -- - - " - - - - - "- - - - -"-
т(А) г вещества А, |
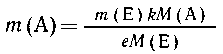
|
Из уравнения (2) имеем пропорцию:
| из аМ(А) г вещества А образуется сМ(С)
г вещества С, |
| из m(А) г -- - - "- - - - -" - - -
--"-"-m (С) г вещества С, |
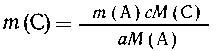
|
Именно так практически каждый второй учащийся
подойдет к решению подобных задач - сначала по
первой реакции, затем по второй. Мы не будем
останавливаться на этом способе, поскольку на
основе элементарной математики, которую изучали
в младших классах, можем пойти дальше.
Подставляя значение т(А), полученное из первой
пропорции, в выражение для т(С) из второй,
приходим к выражению
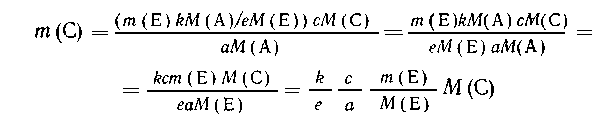
Таким образом, исключив т(А) и М(А) из суммарного
уравнения, мы выяснили, что рассчитывать т(А)
совершенно нет необходимости. Это и есть то самое
дополнительное неизвестное, которого следует
избегать. Из последнего соотношения видно, что
его можно было получить, приведя в соответствие
коэффициенты обоих уравнений реакций и сложив их
левые и правые части, как это всегда делают при
уравнивании окислительно-восстановительных
реакций:
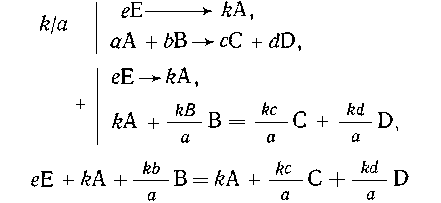
Необходимо отметить, что суммирование
уравнений является чисто формальной
математической операцией. Исключив А и члены, по
которым не ведется расчет (В, D), получим
стехиометрическую схему
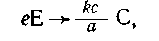 из которой легко
получается выражение для m(С)-
из которой легко
получается выражение для m(С)-
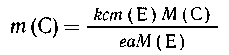
Можно показать, что задача с цепочкой из трех
уравнений решается аналогично. Рассмотрим
пример.
"Определить m(F), если имеется цепочка
превращений: eE  kA (1), аА
kA (1), аА  cС (2), lC
cС (2), lC  fF (3) и известна m(Е)". Решение
этой задачи сводится к следующему. Домножим
уравнение (2) на k/a, чтобы исключить А, и
уравнение (3) на (k/a)(cfl); получаем
fF (3) и известна m(Е)". Решение
этой задачи сводится к следующему. Домножим
уравнение (2) на k/a, чтобы исключить А, и
уравнение (3) на (k/a)(cfl); получаем
Далее складываем все уравнения: 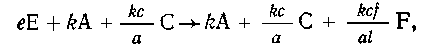 или
или
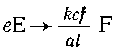
Эту стехиометрическую схему можно
распространить на какое угодно число стадий
цепочки. В общем виде это выглядит так:


Естественно, что в формуле участвуют только
коэффициенты при веществах, которые составляют
саму цепочку.
Пример. Определить массу бертолетовой соли,
которую нужно разложить для выделения кислорода,
, необходимого для получения 10,2 г оксида алюминия
из чистого металла.
Решение. Уравнения реакций:
2КСlO3 2КСl + 3O2
2КСl + 3O2 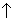 (1)
(1)
3O2 + 4Аl  2Аl2О3. (2)
2Аl2О3. (2)
По выведенным соотношениям стехиометрическая
схема имеет вид
2КСlO3  2Аl2О3. или KClO3
2Аl2О3. или KClO3
 A12O3;
A12O3;
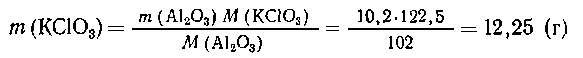
Задачи
1. Оксид натрия массой 6,2 г
растворили в 100 мл воды (раствор /). Затем к
раствору / приливали соляную кислоту с массовой
долей 10% до тех пор, пока реакция среды не стала
нейтральной (получен раствор 2). Определите
массовые доли веществ в растворах / и 2 и массу
раствора соляной кислоты, пошедшей на
нейтрализацию.
2. Сернистый газ, получившийся при
сжигании 179,2 л сероводорода (н. у.), пропущен через
-2 л 25%-го раствора гидроксида натрия (р = 1,28). Каков
состав образующейся соли и какова ее массовая
доля в растворе в процентах?
3. Колонна синтеза аммиака дает 1500 т
продукта в сутки. Сколько азоаюй кислоты 5010-Й
концентрации можно теоретически получить из
этого количества аммиака?
4. Для восстановления 3,2 г оксида
металла требуется 1,344 л водорода. При растворении
полученного металла в избытке соляной кислоты
выделяется 0,896 л водорода. Определите, какой это
металл.
Напишите уравнения всех упомянутых реакций.
(Объемы газов измерены при н. у.)
5. Для получения уксусной кислоты в
качестве исходного вещества был использован
технический карбид кальция, содержащий 4%
примесей. Какое количество карбида было
израсходовано, если известно, что на
нейтрализацию полученной уксусной кислоты
потребовалось 240 г раствора гидроксида калия,
содержащего 5,5 моль КОН в 1 л (плотность 1,20 г/см3).
Считать, что уксусная кислота образуется с
выходом 100%.
6. Глицерин обработали
концентрированной азотной кислотой в
присутствии водоотнимающего вещества. 100 г
полученного вещества взорвали, а продукт реакции
пропустили последовательно через растворы
щелочи, концентрированной серной кислоты и над
нагретой медной спиралью. Оставшийся газ собрали
в мерный цилиндр над водой. Какой это газ? Какова
его масса и объем (н. у.)? Приведите необходимые
уравнения реакций.
7. Пары пропилового спирта пропустили
над оксидом алюминия при 300o С. На
полученный продукт подействовали бромидом
водорода, затем на образовавшееся вещество -
металлическим натрием. Напишите уравнения
происходящих реакций и рассчитайте, из какого
количества пропилового спирта получится 43 г
конечного продукта
8. Неизвестный газообразный
углеводород объемом 10 мл смешали с 70 мл кислорода
и смесь сожгли. По окончании реакции после
конденсации водяных паров объем газовой смеси
составил 65 мл. При пропускании газа в раствор
гидроксида калия объем его уменьшился до 45 мл.
Рассчитайте молекулярную формулу неизвестного
углеводорода, считая, что объемы газов измерены
при н. у.
Решения
1. Оксид натрия реагирует с водой: Na2O
+ H2O = 2NaOH.
При нейтрализации гидроксида натрия соляной
кислотой идет реакция: NaOH + HCl = NaCl + H2O.
Стехиометрическая схема:Na2O  2NaOH
2NaOH  2NaCl.
2NaCl.
Из 6,2/62 = 0,1 моль оксида натрия образуется 0,2 моль,
или 0,2 40 = 8,0
г щелочи. Масса раствора равна 100-1 + 6,2 = 106,2 г, и,
следовательно,массовая доля в нем NaOH равна:
40 = 8,0
г щелочи. Масса раствора равна 100-1 + 6,2 = 106,2 г, и,
следовательно,массовая доля в нем NaOH равна: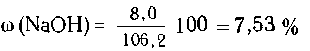
На нейтрализацию потребуется 0,2 моль, или 0,2 36,5 = 7,3 г
кислоты, которая содержится в (100/10)7,3 = 73 г ее
раствора. Масса раствора 2 равна 106,2 + 73 = 179,2 г. В
нем растворено 0,2 моль, или 0,2
36,5 = 7,3 г
кислоты, которая содержится в (100/10)7,3 = 73 г ее
раствора. Масса раствора 2 равна 106,2 + 73 = 179,2 г. В
нем растворено 0,2 моль, или 0,2 58,5 = 11,7 г поваренной соли с
массовой долей
58,5 = 11,7 г поваренной соли с
массовой долей 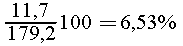
2. 2H2S + 3O2 = 2SO2 + 2H2O;
SO2 + 2NaOH = Na2SO3 + H2O (при
достаточном количестве NaOH); (1)
SO2 + NaOH = NaHSO3. (2).
Из 179,2 л H2S получается 179,2 л SO2, т. е.
179,2/22,4 = 8 моль; раствор NaOH содержит
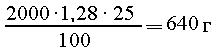 NaOH, т. е. 640/40 = 16
моль.
NaOH, т. е. 640/40 = 16
моль.
Следовательно, протекает реакция (1), и
образуется соль Na2SO3 в количестве 8
моль; ее масса 126 8 = 1008 г. Масса раствора равна
сумме массы раствора щелочи и массы добавленного
сернистого газа: 2560 + 8
8 = 1008 г. Масса раствора равна
сумме массы раствора щелочи и массы добавленного
сернистого газа: 2560 + 8 64 = 3072 г. Массовая доля соли равна
(1008/3072)100 = 32,8%.
64 = 3072 г. Массовая доля соли равна
(1008/3072)100 = 32,8%.
3. Напишем общую схему превращения
аммиака в азотную кислоту: 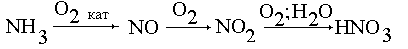
Из схемы видно, что одна молекула NH3 дает
одну молекулу HNO3. Поэтому нам не надо даже
писать уравнений, а можно сразу определить массу
100%-и азотной кислоты:
| 1500 т----"------"--------"x
т |
| NH3
-----"----"-----"----"HNO3 ; |
| 17 т -----"-----"-----"-----63 т |
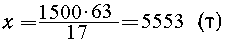 |
50%-и HNO3 можно получить вдвое больше: 11106 т.
4. Общие уравнения реакций:
Мx Oy + уН2  хМ + yН2O,
хМ + yН2O,
М + nНС1  п/2Н2 + МСln
п/2Н2 + МСln
По условию 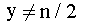 т. е. степени окисления в оксиде
и хлориде не одинаковы.
т. е. степени окисления в оксиде
и хлориде не одинаковы.
Соотношение объемов водорода равно 1,344/0,898 =
3/2, Отсюда металл в оксиде имеет валентность 3, а
при растворении в кислоте отдает 2 электрона
(соотношение валентностей 6/4 маловероятно).
Уравнение реакции:
М2О3 + ЗН2 = 2М + 3Н2О
Было 1,344/22,4 = 0,06 моль водорода, восстановившего
0,02 моль оксида молярной массы 3,2/0,02 = 160 г/моль.
Решаем уравнение 2Ar(М) + 3 16 = 160, откуда Ar(М) = 56.
Искомый металл- железо.
16 = 160, откуда Ar(М) = 56.
Искомый металл- железо.
Fe + 2HCl =FeCl2 + Н2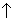 .
.
5.
| СаС2 + 2Н2О = Са (ОН)2
+ С2Н2 ; |
С2Н2 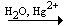 CH3CH=O; CH3CH=O; |
СН3СНО  СН3СООН; СН3СООН; |
| СН3СООН + КОН = СН3СООК
+ Н2О. |
Объем раствора 240/1,2 = 200 мл.
| 1л - 5,5 моль, |
| 0,2 л - х моль, |
| x =1,1 моль КОН. |
1,1 моль КОН нейтрализует 1,1 моль уксусной
кислоты. Суммарная схема получения кислоты:
СаС2 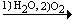 СН3СООН.
СН3СООН.
Из 1 моль СаС2 получается 1 моль СН3СООН;
1,1 моль кислоты - из 1,1 моль СаСа, что составляет 64 1,1 = 70,4 г
чистого вещества. Масса израсходованного
технического карбида кальция равна
1,1 = 70,4 г
чистого вещества. Масса израсходованного
технического карбида кальция равна
| 70,4 г - 96%, |
| х г- 100 %, |
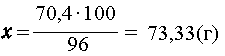 |
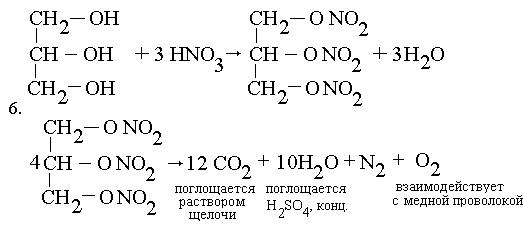
В мерный цилиндр собирают азот. Из 4 моль
нитроглицерина образуется 6 моль азота;
227 4 г -----"---" 6 4 г -----"---" 6 28 г, или 6 28 г, или 6 22,4 л N2, 22,4 л N2, |
| 100 г ----"-----" х
г, или у л N2, |
| х = 18,5 г N2, y = 14,8 л N2. |

Из 2 моль С3Н7ОН образуется 1 моль С6Н14;
2  60 г----------- 86 г, 60 г----------- 86 г, |
| х г -----------------43 г. |
х = 60г. |
8. Неизвестный углеводород имеет
формулу СxНy.
Уравнение реакции: СхНу + (х+у/4) O2
= хСО2 + у/2Н2О.
 (СхНy)
= 0,010/22,4 (моль).
(СхНy)
= 0,010/22,4 (моль).
Баланс О2: до реакции 70 мл, или 0,070/22,4 моль;
после реакции и поглощения СО2 - 45 мл, или
0,045/22,4 моль; следовательно, в реакцию вступило
0,025/22,4 моль О2.Для образования 0,020/22,4 моль СО2
в реакцию с углеродом углеводорода вступило
0,020/22,4 моль О2. Оставшиеся 0,005/22,4 моль О2
прореагировали с водородом углеводорода, при
этом было получено 0,010/22,4 моль воды.
 (С) =
(С) =  (CO2)
= 0,020/22,4;
(CO2)
= 0,020/22,4;
 (H) = 2
(H) = 2 (H2O) =
0,020/22,4;
(H2O) =
0,020/22,4;
x:y = v(C) : (H) = 0,020: 0,020=1 : 1.
(H) = 0,020: 0,020=1 : 1.
Из всех возможных ответов: С2Н2, (С3Н3),
C4H4 (C5H5 ) и т. д. - условию
задачи удовлетворяет только С2Н2;
таким образом, неизвестный углеводород -
ацетилен.


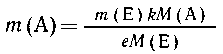
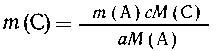
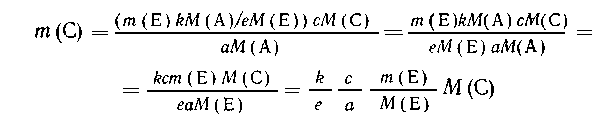
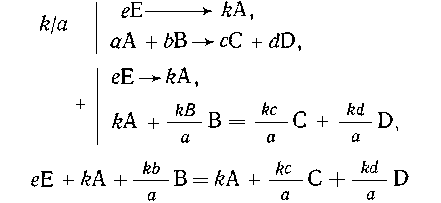
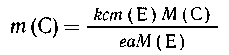
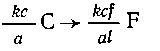


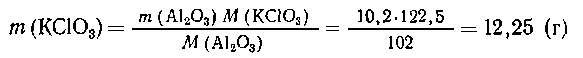
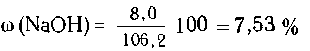
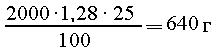 NaOH, т. е. 640/40 = 16
моль.
NaOH, т. е. 640/40 = 16
моль.