Школьные олимпиады по химии
Всероссийская олимпиада школьников по химии - 2004 года
Всероссийская олимпиада школьников по химии - 2004 года
"ЗАДАЧИ ПО ВЫБОРУ"
Уважаемые участники!
В тур по выбору включены четыре блока
задач: "Неорганическая химия",
"Органическая химия","Физическая
химия" и "Химия и жизнь". Каждая задача
оценивается в 15 баллов. В Ваш актив будут зачтены четыре
решенные Вами задачи с максимальным результатом.
Обязательное условие: участники из 9
классов выбирают задачи не менее, чем из двух
(2) различных блоков, из 10 классов – не менее,
чем из трех (3) блоков, из 11 классов – не менее,
чем из четырех (4) блоков.
Желаем удачи!
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Задача 1.
" За выдающиеся заслуги в развитии
химии:
открытие элементов радия и полония, выделение
радия и
изучения природы соединений этого
замечательного элемента."
(Нобелевская премия по химии М. Кюри 1911 г)
"Описанным выше процессом я получила в марте
1902 года 0,12 гр. хлористого радия,
спектрально-аналитическое изследование
которого было произведено Демарсе. По мнению
Демарсе, этот хлористый радий был почти чист; тем
не менее спектр его давал еще три главных линии
бария в заметной степени. Я произвела над этим
хлоридом четыре последовательных определения с
таким результатом:
| |
Число грамов безводного
хлористого радия |
Число грамов хлористого
серебра |
I |
0.1150 |
0.1130 |
II |
0.1148 |
0.1119 |
III |
0.11135 |
0.1086 |
IV |
0.10925 |
0.10645 |
Затем я принялась за новую очистку этого
хлорида и получила еще более чистое вещество, в
спектре которого обе сильнейшия бариевы линии
были заметны лишь в слабой степени. Принимая во
внимание чувствительность спектральной реакции
на барий, Демарсе высказал мнение, что этот
очищенный хлорид содержал лишь "минимальные
следы бария, которые не могли бы уже оказать
чувствительного влияния на атомный вес". Над
этим совершенно чистым хлористым радием я
произвела три определения с таким результатом:
| |
Число грамов
безводного хлористого радия |
Число грамов
хлористого серебра |
I |
0.09192 |
0.08890 |
II |
0.08936 |
0.08627 |
III |
0.08839 |
0.08589 |
(М.Склодовская-Кюри "Радий и
радиоактивность", (пер. А. И. Бачинскогго), М.,
"Творческая мысль", 1905.)"
1.Рассчитайте значения атомных масс радия,
полученных в экспериментах М. Кюри. Рассчитайте
среднеарифметическое значение атомной массы
радия в первом и во втором (очищенном) случае ( A ± D ). Сравните с современными данными.
2.Рассчитайте содержание радия в этих двух
образцах: в моль.%?( ±  ) и масс.% (
) и масс.% (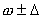 ) (по металлу).
) (по металлу).
3.Почему, на Ваш взгляд, М. Кюри была вынуждена
проводить еще одну дополнительную очистку
(почему М. Кюри не устроил первый полученный
результат?)? Постарайтесь аргументировать
численно Ваш ответ, учитывая, что это происходило
в 1902 году.
4.Напишите уравнение реакции образования радия в
урановых рудах.
5.Классик писал: " Поэзия - /та же добыча радия./ В
грамм добыча,/ в год труды./ Изводишь /единого
слова ради/ тысячи тонн/ словесной руды." Кто
автор? Оцените, сколько тонн (минимально)
урановой руды (U3O8) надо было
"извести" М. Кюри для получения этого
препарата, если периоды полураспада составляют: 234U
- 2,45.105 лет; 235U - 7,04.108;
238U - 4,46.109; 223Ra - 11,43 дня; 224Ra
- 3,66 дня; 226Ra - 1600 лет; 228Ra - 5,75 лет.
6.М. Кюри установила, что торий является еще одним
естественнорадиоактивным элементом. При
распаде тория также образуется радий. Напишите
уравнение реакции. Какое значение атомной массы
радия могла бы получить М. Кюри, если бы для
выделения радия она использовала ториевые руды.
А смогла бы? (T1/2 (232Th)= 1,4.1010лет)
7.Напишите два примера уравнений химических
реакций для хлорида радия, которые
характеризовали бы его свойства.
Задача 2.
"…и Фаэтон, среди небесных ям
лавируя, сгорая, озаряет
до смертных мук неведомое нам!"
(Бахыт Кенжеев)
Три соединения (I - III) с одинаковым качественным
составом могут быть получены при термической
обработке газовой смеси при разных условиях.
Условия синтеза этих соединений представлены в
таблице.
В-во |
Плотность исходной
смеси (по воздуху) |
Давление синтеза, атм |
Температура синтеза, оС |
Выход, % |
I |
2,919 |
1 |
400 (-50) |
99 |
II |
1,847 |
6 |
400 |
99 |
III |
1,464 |
60 |
200-250 |
95 |
Все полученные соединения могут
экзотермически взаимодействовать с кремнием,
образуя только газообразные продукты, плотность
которых и другие данные о синтезированных
соединениях приведены в следующей таблице.
В-во |
Плотность веществ, г/см3 |
tпл., оС |
Давление, мм Hg (25o) |
DHсубл.,
кДж/моль |
DfHo298,
кДж/моль |
Плотность продуктов |
I |
4,32 |
140 |
3,8 |
51 |
-176 |
4,215 |
II |
4,04 |
114 |
3 |
63,6 |
-251 |
4,058 |
III |
- |
46 |
29 |
37,6 |
-401 |
3,964 |
1. Определите состав I-III (формулы).
2. Рассчитайте качественный и количественный
состав исходных смесей для синтеза (моль. %).
3. Определите качественный и количественный
(моль. %) состав газовых смесей, образующихся при
взаимодействии I-III с кремнием.
4. Напишите уравнения реакций синтеза и
взаимодействия I-III с кремнием.
5. Каково строение I-III ? ( рисунок )
6. Соединение III довольно активно реагирует не
только с кремнием, но и оксидом кремния (IV). Что
при этом образуется ? (уравнение реакции).
7. Рассчитайте энергии связей (кДж/моль) в
соединениях I-III, приняв, что энергия связи в одном
из исходных веществ составляет 155 кДж/моль.
8. В первой таблице приведены численные значения
выхода. Определите, по какому компоненту
определялся выход.
Задача 3.
"Но упрямо применял он
только угль, только мел
словно синим или алым
мыслить сроду не умел"
(Бахыт Кинжеев)
В лаборатории хранятся две старые реактивные
склянки 1904 года выпуска с полуистлевшими
этикетками. На одной из них можно прочитать
только "…umSaure" (реактив А), на второй
– "…миамат калия" (реактив Б).
Реактив А получается окислением
соответствующего металла диоксидом азота при
нагревании. Реактив Б получают обработкой А
концентрированным аммиаком в сильнощелочной
среде (степень окисления и координационное число
металла при этом не изменяются). По данным
выборочного химического анализа, Б содержит
13,39% калия и 4,81% азота.
Вещество А проявляет слабо выраженные
кислотные свойства. Так, взаимодействие его с
холодным концентрированным раствором щелочи
приводит к образованию соединения В, которое
в присутствии восстановителя переходит в
соединение Г (для Г и В характерно
октаэдрическое окружение центрального атома). По
результатам химического анализа, соединение Г
содержит воду, однако рентгеноструктурное
исследование не подтвердило этот факт.
При подкислении раствора, содержащего 230,1 мг Г,
происходит его диспропорционирование с
выделением 79,44 мг вещества А и 69,44 мг вещества Д,
являющегося оксидом. Указанное количество
вещества А выделяет иод из подкисленного
раствора иодида калия, на титрование которого
идет 25 мл 0,05М раствора тиосульфата натрия (вместе
с иодом выделяется продукт Д).
1. Химия какого металла рассмотрена в задаче?
2. Приведите химические формулы и названия
соединений А – Д. Где это необходимо,
ответ подтвердите расчетами. Восстановите
названия на этикетках.
3.Приведите координационные формулы соединений Б,
В, Г.
4.Какова степень окисления металла в соединениях А
и Б? Какие еще элементы Периодической
Системы могут проявлять такую степень окисления?
5.Запишите уравнения всех оговоренных в условии
реакций.
Задача 4.
"…как, у тебя снова перхоть?…"
(Реклама)
На представленной ниже схеме вещества A1-A7
содержат элемент Y, B1-B6 –
элемент X. C1 и C2 – изомеры,
содержат как X, так и Y.
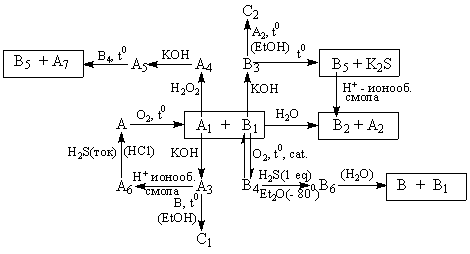
Принятые сокращения:
Et – C2H5
сat. – катализатор
eq – эквивалент
Дополнительная информация: Вещества А и
B имеют общий структурный фрагмент и
используются как средства против перхоти.
Антисептическое действие В было известно в
древности.
М. Д. Машковский (Лекарственные средства. М.
"Медицина", 1987 г, т 2) указывает что порошок А
носит название "сульсен" и имеет состав: 45% X
и 55% Y.
Кислота B2 - продукт крупнотоннажного
производства, ключевая стадия которого
окисление газа B1 до B4. Сильная
двухосновная кислота А4 растворяет
золото.
Вопросы:
1.Определите состав всех упомянутых в условии
соединений, обоснуйте свой выбор расчетом.
Напишите полные уравнения реакций, приведенных в
задаче.
2.Объясните действие спирта при получении C1
и C2? Известно, что увеличение
содержания EtOH в реакционной смеси существенно
ускоряет ход реакции. (Реакция проводится в
водно-спиртовой среде).
3.Предложите возможное строение соединения A.
Объясните противомикробное действие А и В.
4.Приведите три вещества, использующихся в
качестве катализаторов окисления B1.
5.Напишите уравнение реакции между Au и А4,
расставьте коэффициенты в этом превращении
методом полуреакций.
Задача 5.
"И камень превращается в песок"
(Бахыт Кенжеев)
Для исследования превращений, происходящих с
кислородными соединениями Б-Д элемента А
при нагревании проводилось 2 серии
экспериментов: 1,0000 г каждого из веществ медленно
нагревали в платиновом тигле. Первый эксперимент
проходил под давлением кислорода, второй – в
атмосфере аргона.
Результаты опытов:
Вещество |
Б |
В |
Г |
Д |
Цвет |
белый |
Желтоватый |
желтый |
красный |
 m1,
г m1,
г
|
+0.3404 |
+0.1454 |
-0.1127 |
-0.2759 |
 m2,
г m2,
г
|
-0.5532 |
-0.2364 |
-0.1127 |
-0.2759 |
В ходе дальнейших экспериментов выяснилось,
что конечный продукт реакции в каждом случае был
один – вещество Е.
Свойства Е были тщательно исследованы: это
был порошок желтого цвета, растворимый в воде и
кристаллизующиеся из раствора в форме
устойчивого тригидрата. Внесение Е в
разбавленную соляную кислоту сопровождалось
образованием коричневого осадка Ж, широко
используемо в химической практике. Действие
гидразинана раствор Е дает черный осадок З,
используемый в тех же процедурах что и Ж.
Однако эти результаты не согласовывались с
предположениями исследователей, которые
приведены в таблице:
Вещество |
Б |
В |
Г |
Д |
 m1, г m1, г
|
+0.1702 |
0 |
-0.2254 |
-0.3678 |
 m2, г m2, г
|
-0.4149 |
0 |
-0.2254 |
-0.3678 |
Вопросы:
·Определите вещества А-Д.
Объясните причину несогласования
предположений и эксперимента, напишите
уравнения химических превращений. Приведите
схемы предполагаемых экспериментаторами
процессов.
· Напишите формулы соединений Е-З,
объясните устойчивость тригидрата Е.
· Приведите примеры использования
Ж и З в химической практике.
· Предложите условия проведения
эксперимента, в которых удастся оценить
справедливость предположений исследователей.
· Предложите по одному
лабораторному способу получения Б-Д из
А.
Задача 6.
"Не роняй слезы, если злато ржавеет,
есть
добрый пуд листового железа и чугуна."
(Бахыт Кенжеев)
Методика синтеза нитропруссида натрия
(вещество А) включает следующие операции.
К раствору 120 г желтой кровяной соли (в расчете на
тригидрат) и 78 г нитрита натрия в 240 мл воды,
нагретому до 85 оС, очень медленно
приливают раствор 68 г серной кислоты (пл. 1,84) в 240
мл воды. Кислоту приливают с такой скоростью,
чтобы температура смеси не поднималась выше 85-90 оС.
После введения всей кислоты приливают еще 30 мл
такого же раствора H2SO4 и жидкость
нагревают 1-2 ч до 100 оС.
Затем раствор испытывают. Пробу 0,5 мл раствора
разбавляют до 3 мл и делят пополам. К первой части
добавляют несколько капель раствора FeSO4, ко
второй - раствора CuSO4.
При положительном результате испытаний к
раствору добавляют еще 2-3 г нитрита натрия и
нагревают.
При отрицательной реакции на тестируемые ионы
жидкость фильтруют в фарфоровую чашку и
добавляют при перемешивании нагретый до 80 оС
раствор 73 г медного купороса в 150 мл воды. После
отстаивания жидкость декантируют и осадок
промывают декантацией теплой (25-30 оС)
водой.
Отмытый светло-зеленый осадок вещества Б
разлагают концентрированным раствором 40 г NaHCO3,
раствор фильтруют, осадок на фильтре промывают
водой, соединяя промывные воды с фильтратом.
Фильтрат подкисляют 6-8 мл уксусной кислоты и
упаривают до половины объема. В полученный
раствор добавляют 1,5-2 г ацетата бария, фильтруют,
упаривают на водяной бане до появления толстой
кристаллической пленки и охлаждают. Выпавший
препарат перекристаллизовывают из горячей воды
и сушат при температуре не выше 40 оС. При 80 %
выходе получается 67,7 г нитропруссида натрия.
1. Установите состав и строение целевого
препарата А и промежуточного продукта Б.
В дополнение к данным из методики у Вас имеются
результаты С, Н, N анализа для очищенных
соединений: А – 20,15 % С, 1,34 % Н, 28,21 % N; Б – 21,48
% С, <0,1 % Н, 30,08 % N. Назовите эти соединения по
современной номенклатуре.
2. Какова цель испытаний, проводимых с пробой
раствора по окончании 1-й стадии процесса?
Напишите уравнения реакций, соответствующих
положительным результатам испытаний и опишите
наблюдаемые в ходе этих реакций явления.
3. Чем обусловлена необходимость медленного и
постадийного введения серной кислоты в
реакционную смесь? Можно ли изменить порядок
добавления реагентов (сначала добавить всю
кислоту, а затем – медленно – нитрит)? Можно ли
использовать красную кровяную соль вместо
желтой? Обоснуйте свои ответы.
4. Напишите уравнения реакции желтой кровяной
соли с нитритом натрия в кислой среде и реакции Б
с раствором NaHCO3.
5. С какой целью конечный раствор подкисляют
уксусной кислотой и зачем к нему добавляют
ацетат бария?
6. При нагревании до 400 оС нитропруссид
натрия разлагается, причем масса остатка
составляет 53,0 % от массы исходной навески. Какие
соединения остаются в остатке? Напишите
уравнение реакции.
7. Достаточно стабильный в полной темноте красный
водный раствор нитропруссида при хранении даже
на рассеянном свету в течение нескольких часов
окрашивается в интенсивный синий цвет. Напишите
уравнение реакции, проходящей непосредственно
под действием света и попробуйте качественно
объяснить дальнейшие изменения в составе
раствора, которые могут привести к такой резкой
смене окраски.
ОРГАНИЧЕСКАЯ ХИМИЯ
Задача 1.
Однажды в руки юному химику
Книжникову в руки попал старый лабораторный
журнал, в котором среди прочих упоминался синтез
метилового эфира
3-диметиламино-4-формилциклогексанкарбоновой
кислоты (1) из
2-(2-диметиламиноэтил)-1,3-бутадиена (2) и
метилакрилата.
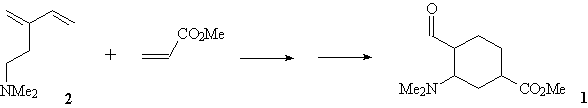
Однако страницы, на которых был описан этот
синтез, в журнале отсутствовали. Тем не менее,
Книжникову удалось разобраться, как можно
выполнить это превращение. Чтобы проверить свою
догадку, он синтезировал соединение (2), а
затем и соединение 1, которое получил в виде
смеси диастереомеров.
1) Предложите свой вариант синтеза
соединения 1, который включал бы в себя не
более семи химических стадий (с указанием
реагентов и структур промежуточных продуктов).
2) На каких стадиях использование избытка
реагентов (каких?) приводит к образованию
побочных продуктов (каких?)?
3) Сколько всего существует изомеров
соединения 1?
4) Сколько стереоизомеров этого соединения
образуется в вашем синтезе? Предложите способы
их разделения.
5) Как можно синтезировать исходное
соединение 2? Приведите схему синтеза с
указанием реагентов.
Задача 2.
Одним из наиболее изысканных деликатесов
считаются трюфели, запах которых некоторые даже
называют "божественным". Запах этот
обусловлен в первую очередь соединением А.
Если 0,324 г соединения А обработать
подкисленным раствором соли ртути (II), отделить
неорганические соединения от органических и
добавить к последним избыток аммиачного
раствора оксида серебра, выпадает 2,226 г осадка.
Если вместо добавления серебряной соли
полученный продукт оттитровать иодом,
обесцвечивание иода прекращается после
добавления 0,762 г иода. Наконец, пропускание
газовой смеси, образующейся при сжигании того же
количества соединения А, через известковую
воду приводит к осаждению 1,716 г осадка. Если же
равное количество газовой смеси пропустить
через раствор NaOH, а через некоторое время
добавить к продукту раствор хлорида кальция,
масса выпавшего осадка составила 1,734 г.
1) Определите структуру вещества А. Ответ
подтвердите расчетами.
2) Напишите уравнения всех описанных
реакций.
3) Напишите, какие продукты могут
образоваться при добавлении циклогексанона к
реакционной смеси, полученной в результате
добавления к соединению А подкисленного
раствора соли ртути.
4) Объясните различия в массах выпавших
осадков при пропускании газовой смеси через
известковую воду и через раствор едкого натра с
последующим добавлением хлорида кальция.
Задача 3.
Ниже приведена схема превращений:
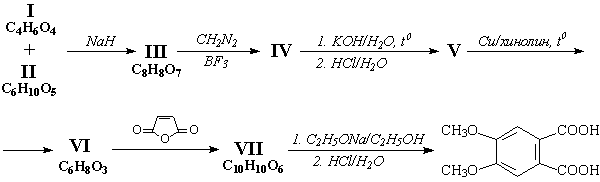
Напишите структурные формулы веществ I – VII.
Задача 4.
Ниже приводится схема синтеза одного из
изомерных углеводородов F(C30H22)
весьма интересного строения (Кемпбелл с сотр.):
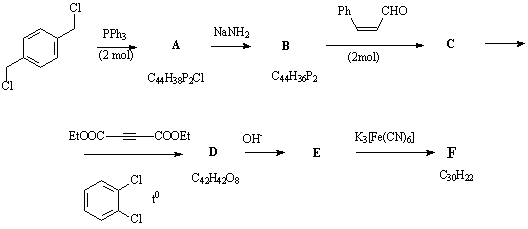
Напишите структурные формулы соединений А-F.
Задача 5.
Расшифруйте указанную ниже цепь превращений:
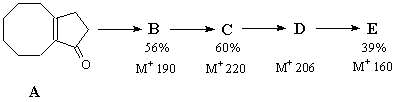
Данные 1Н спектров указанных соединений:
В: 0,7-2,3 (m, 15H), 2,6-3,1 (m, 1H), 5,95 (d, 1H), 6,15 (d, 1H)
C: 1,2-2,1 (m, 14H), 2,86 (t, 1H), 3,54 (s, 3H), 5,99 (d, 1H), 6,23 (d, 1H)
D: 1,0-1,9 (m, 14H), 2,96 (t, 1H), 6,10 (d, 1H), 6,25 (d, 1H), 11,86 (s, 1H)
E: -0,4 (2H), 0,33 (2H), 2,49 (2H), 7,17 (4H)
Указанные превращения протекают в следующих
условиях:
А  В 1)фотоциклоприсоединение
1,2-дихлорэтилена
В 1)фотоциклоприсоединение
1,2-дихлорэтилена
2) tо, этиленгликоль, Н+
3) Na, NH3, восстановительное
дегалогенирование
4) Н+
В С Фотоперегруппировка ?-диазокетона
С Фотоперегруппировка ?-диазокетона
1) HCOOH, NaOEt
2) Тозилазид
3) h?, МеОН
С  D Гидролиз, КОН
D Гидролиз, КОН
D  E Окислительное декарбоксилирование:
Pb(OAc)4 в присутствии Cu(OAc)2,бензол, 800,
1ч.
E Окислительное декарбоксилирование:
Pb(OAc)4 в присутствии Cu(OAc)2,бензол, 800,
1ч.
"Для соединения Е существенных изменений в ИК-, УФ- и ЯМР-спектрах
по сравнению с обычными ароматическими соединениями не наблюдалось" (Tetrahedron,
1986, v. 42, № 6, p.1858).
Для соединения Е описаны следующие химические свойства:
1) Термическая изомеризация в паровой фазе с образованием соединения
F (90%), М+ 160, 1Н 1,2-1,8 (m, 10H), 4,69 (s,
2H), 5,80 (d, 2H), 6,05 (d, 2H).
2) Фотохимическая изомеризация с количественным образованием соединения
G, [1Н 1,50(m, 8H), 1,8 (m, 4H), 6,53 (s, 4H)], которое при
нагревании от 500 до 900 С быстро и полностью превращается
в исходное Е.
3) Кислотно-каталитическая изомеризация с образованием
Н и I; оба соединения в спектрах 1Нсодержат сигналы
в области алифатики 1,2-1,9 (m, 12H) и в области ароматики: H - 2 сигнала
(d и t, 1:1), I – 3 сигнала (d, t и s, 2:1:1).
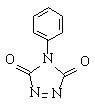 4) Реакция Дильса-Альдера с
N-фенил-1,2,4-триазолин-3,5-дионом с образованием J,
М+ 335, 1Н 0,2-0,6 (m, 2H), 0,9-1,3 (m, 2H), 1,6-2,2 (m, 6H),
2,3-2,6 (m, 2H), 5,17 (m, 2H), 6,33 (d, 2H), 7,4-7,6 (m, 5H).
4) Реакция Дильса-Альдера с
N-фенил-1,2,4-триазолин-3,5-дионом с образованием J,
М+ 335, 1Н 0,2-0,6 (m, 2H), 0,9-1,3 (m, 2H), 1,6-2,2 (m, 6H),
2,3-2,6 (m, 2H), 5,17 (m, 2H), 6,33 (d, 2H), 7,4-7,6 (m, 5H).
5) Присоединение брома при 0оС
с образованием неустойчивого соединения K [1Н
1,3-1,6 (m, 8H), 2,2-2,4 (m, 4H), 6,99 (s, 4H)], которое уже при
комнатной температуре образуется два дибромида
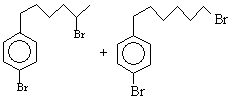
Вопросы
1. Напишите структурные формулы соединений В-К.
2. Объясните, почему в 1Н спектре Е один из сигналов
находится в области отрицательных значений (-0,4).
3. Приведите Ваше объяснение химическим свойствам Е, нехарактерным
для ароматическим соединений – реакция Дильса-Альдера, присоединение брома.


 ) и масс.% (
) и масс.% (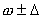 ) (по металлу).
) (по металлу).

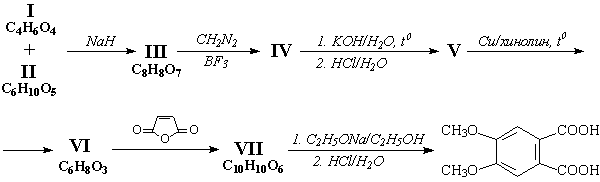

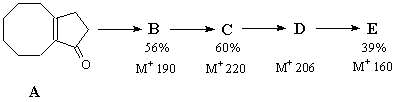
 4) Реакция Дильса-Альдера с
N-фенил-1,2,4-триазолин-3,5-дионом с образованием J,
М+ 335, 1Н 0,2-0,6 (m, 2H), 0,9-1,3 (m, 2H), 1,6-2,2 (m, 6H),
2,3-2,6 (m, 2H), 5,17 (m, 2H), 6,33 (d, 2H), 7,4-7,6 (m, 5H).
4) Реакция Дильса-Альдера с
N-фенил-1,2,4-триазолин-3,5-дионом с образованием J,
М+ 335, 1Н 0,2-0,6 (m, 2H), 0,9-1,3 (m, 2H), 1,6-2,2 (m, 6H),
2,3-2,6 (m, 2H), 5,17 (m, 2H), 6,33 (d, 2H), 7,4-7,6 (m, 5H). 