Обязательный тур (девятый класс решения)
Задача 9-1.
1.
2FeSO4 .7H2O = Fe2O3 + SO2+
SO3+ 14H2O
SO3 + H2O = H2SO4
Тогда на моль образовавшейся кислоты
приходится 13*18 =234 (г) воды. Массовая доля
составляет 98:(98+234) = 0,295 или 29,5%.
2. В 100 г раствора полученной кислоты
содержится 70,5 г воды (3,9 моль). Для превращения ее
в серную требуется 3,9 моль SO3 (312 г). А для
образования 10%-ного олеума необходимо еще (100 +
312).0,1/0,9= 45,7 г SO3 (0,57 моль). Всего 4,47 моль SO3.
Для получения такого количества SO3
требуется 8,94 моль FeSO4 или 1359 г.
3. Максимальная концентрация хлороводорода
соответствует эквимолярному соотношению серной
кислоты и хлорида бария:
BaCl2 + H2SO4 = BaSO4+ 2HCl
В 100 г раствора содержится 29,5 г H2SO4
(0,301 моль). Дигидрата хлорида бария прореагирует
0,301 моль ( 73,5 г). Сульфата бария выпадет в осадок
0,301 моль (70,2 г). Хлороводорода получится 0,602 моль
(21,9 г). Масса раствора составит 100 + 73,5 - 70.2 = 103,3 (г).
Доля хлороводорода в растворе составит 21,9 : 103,3 =
0,212 или 21,2%.
Задача 9-2
1. Содержание калийной селитры (нитрата калия) в
порохе составляет: 4,64:(4,64+1) = 0,823 или 82,3%.
Содержание серы и угля, соответственно,
составляет 17,7%.
Содержание угля - 17,7:(1,23+1) = 7,94(%).
Содержание серы - 17,7 - 7,94 = 9,76 (%).
2. Молярное соотношение селитры, серы и угля в
порохе составляет:
 (KNO3) :
(KNO3) :  (S) :
(S) :  (C) = 82,3/101 : 9,76/32 : 7,94/12 = 0,815 : 0,305 : 0,662 =
2,67:1:2,17 =
(C) = 82,3/101 : 9,76/32 : 7,94/12 = 0,815 : 0,305 : 0,662 =
2,67:1:2,17 =
= 16,02:6:13,02 (округляя до целых чисел, соотношение
составит: 16KNO3 + 6S + 13C). Это соотношение можно
считать левой частью уравнения горения (исходные
вещества).
Можно определить сумму коэффициентов
газообразных продуктов горения. Масса исходных
веществ составляет 16 *101 + 6 * 32 + 13*12 = 1964 (г).
Объем газообразных продуктов в
реакции 216 *1964/1000 = 424 (л); количество газовых
продуктов реакции составляет 424/22,4 = 18,9 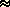 19 (моль). Основными газовыми
продуктами могут быть азот (16 : 2 = 8 (моль в
уравнении реакции), оксид углерода (IV) (до 13 моль в
уравнении реакции) и оксид серы (IV) (в избытке
окислителя). По реакции образуется 19 моль газа,
тогда это 8 моль N2 и 11 моль CO2 (остающиеся
2 моль будут в твердом остатке, связанными в K2CO3
– 2 моль). В твердом остатке будет еще 12 моль
калия, которые потребуются для связывания серы
(как в форме сульфата калия, так и сульфида калия,
так как окислителя в смеси недостаточно для
перевода всей серы в сульфат). При образовании
азота мы должны затратить 16*5 = 80 электронов:
19 (моль). Основными газовыми
продуктами могут быть азот (16 : 2 = 8 (моль в
уравнении реакции), оксид углерода (IV) (до 13 моль в
уравнении реакции) и оксид серы (IV) (в избытке
окислителя). По реакции образуется 19 моль газа,
тогда это 8 моль N2 и 11 моль CO2 (остающиеся
2 моль будут в твердом остатке, связанными в K2CO3
– 2 моль). В твердом остатке будет еще 12 моль
калия, которые потребуются для связывания серы
(как в форме сульфата калия, так и сульфида калия,
так как окислителя в смеси недостаточно для
перевода всей серы в сульфат). При образовании
азота мы должны затратить 16*5 = 80 электронов:
N+5 + 5 e = N0, при окислении
углерода можно освободить 13*4 = 52 электрона:
C0 - 4e = C+4,
еще 28 электронов должно быть образовано в
реакциях серы. При окислении всей серы до
сульфата образовалось бы 6*6 = 36 электронов, то
есть не вся сера образует сульфат, а только пять
моль и при этом образуется моль сульфида калия (6*5
=30; 30-2 = 28, что вполне соответствует электронному
балансу).
К аналогичному выводу можно прийти, исходя из
материального баланса кислорода. Из исходных 48
моль атомов кислорода нитрата калия в газовой
фазе будут 22 моль атомов в CO2, 6 моль атомов
кислорода будут в твердом остатке в составе
карбоната калия, тогда на образование сульфата
остается 48 -22 - 6 = 20; 20 : 4 = 5 - моль сульфата калия
образуется в реакции. По балансу калия и серы
можно определить, что еще может образоваться 1
моль сульфида калия. Уравнение Бертло имеет вид:
16KNO3 + 6S + 13C = 5K2SO4 + K2S
+ 2K2CO3 + 11CO2 + 8N2
3. Масса исходных веществ составляет 16*101 + 6* 32 + 13*12
= 1964 (г).
Тогда тепловой эффект реакции составляет 641 *
1,964 = 1259 (ккал) или 1259 *,18 =5262 кДж.
4. А.С.Пушкин, "Полтава".
Окраска определяется присутствием калия
(паров) в составе пороховых газов (так же как соли
калия окрашивают пламя, только в гораздо большей
концентрации из-за высокой температуры). Дым -
результат конденсации твердых продуктов горения
пороха (сам по себе белый). Поднимался вверх за
счет высокой температуры продуктов при
экзотермической реакции.
5. “Нагар” - твердые остатки продуктов реакции
горения пороха. Заметным запахом обладает только
сульфид калия. Запах сероводорода, который
образуется в результате гидролиза сульфида (или
взаимодействия с углекислым газом воздуха):
K2S + H2O 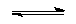 KHS + KOH
KHS + KOH
KHS + H2O 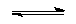 KOH
+ H2S
KOH
+ H2S
6. Твердый остаток - K2SO4, K2CO3,
K2 S. Для доказательства их присутствия в
твердом остатке продукты горения можно
растворить в воде. К полученному раствору
прилить избыток раствора нитрата бария,
образующийся белый осадок может содержать
сульфат и карбонат бария. Сульфид остается в
растворе, и после отделения осадка может быть
обнаружен при действии нитрата свинца, или
нитрата меди по образованию черного осадка
сульфидов свинца (меди):
K2SO4 + Ba(NO3)2 = BaSO4
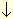 + 2KNO3
+ 2KNO3
K2CO3 + Ba(NO3)2 = BaCO3
 + 2KNO3
+ 2KNO3
K2S + Pb(NO3)2 = PbS  + 2 KNO3
+ 2 KNO3
Полученный осадок (после фильтрования или
декантации) можно обработать раствором соляной
кислоты, выделение газа свидетельствует о
присутствии карбоната, а остающийся
нерастворимым осадок в соляной кислоте - о
наличии сульфата:
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
+ H2O

