ЗАДАНИЯ ТЕОРЕТИЧЕСКОГО ТУРА
33 МХО Задача 1
Атом водорода и молекула водорода
Длины волн в спектре атома водорода впервые
были описаны швейцарским учителем Бальмером. Он
предложил эмпирическую формулу для серии линий: ![]()
![]() 109678 см- 1 –
постоянная Ридберга, me – масса
электрона. Нильс Бор вывел эту формулу
теоретически в 1913 г. и обобщил ее на все
одноэлектронные атомы/ионы.
109678 см- 1 –
постоянная Ридберга, me – масса
электрона. Нильс Бор вывел эту формулу
теоретически в 1913 г. и обобщил ее на все
одноэлектронные атомы/ионы.
1.1.Рассчитайте самую большую длину
волны в ![]() (1Е = 10- 10
м) в серии Бальмера для одноэлектронного иона
гелия (He+). При расчетах движением ядер
можно пренебречь.
(1Е = 10- 10
м) в серии Бальмера для одноэлектронного иона
гелия (He+). При расчетах движением ядер
можно пренебречь.
1.2. Формула, аналогичная формуле
Бальмера, описывает серии спектральных линий в
атоме водорода, которые наблюдаются при
переходах с более высоких энергетических
уровней на самый низкий (основной)
энергетический уровень. Напишите эту формулу и с
ее помощью определите энергию основного
состояния атома водорода (в эВ).
Атом мюония подобен атому водорода, в котором
электрон заменен на более тяжелую отрицательную
частицу – мюон. Масса мюона равна примерно 207
массам электрона, а заряд равен заряду электрона.
Мюон неустойчив, но в данной задаче это не
учитывается.
1.3.Рассчитайте энергию низшего
(основного) состояния и радиус первой боровской
орбиты атома мюония. Ядро можно считать
неподвижным. Радиус первой боровской орбиты
атома водорода (боровский радиус): а 0=
0.53 Е.
В квантовомеханическом описании атома водорода
вместо боровских "орбит" используют понятие
"орбиталь". Орбиталь y 1s(r ) для
основного состояния атома водорода имеет вид:
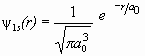
где r – расстояние от электрона до ядра, a0 – боровский радиус.
1.4 Рассмотрим сферическую оболочку радиуса a0 и толщиной сферического слоя 0.001a0. Оцените вероятность нахождения электрона в этой оболочке.
Молекула H2 может диссоциировать по двум различным каналам:
(1) H2 ![]() H + H (два атома
водорода)
H + H (два атома
водорода)
(2) H2 ![]() H+ + H- (протон и
гидрид-ион)
H+ + H- (протон и
гидрид-ион)
Зависимость энергии (E) молекулы H2
от межъядерного расстояния (R) приведена на
графике. Энергия молекул дана в той же шкале, что
и энергия атомов. 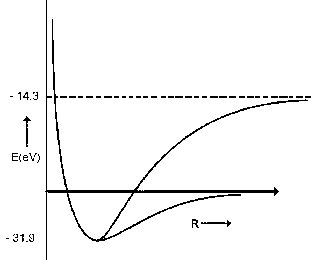
1.5 Укажите, какому каналу диссоциации соответствует каждая кривая.
1.6 Определите значения (в эВ) энергии диссоциации (De) молекулы H2, соответствующие каждому каналу диссоциации.
1.7.Из приведенных данных рассчитайте
изменение энергии для процесса H- ![]() H + e-
H + e-
1.8 Ион H- – двухэлектронная частица. Считая, что формула Бора применима для каждого электрона при замене заряда ядра Z на эффективный заряд Zeff, рассчитайте Zeff для H- .
33 МХО Задача 2
Фосфорная кислота
Фосфорная кислота используется в производстве минеральных удобрений. Кроме того, фосфорная кислота и ее различные соли применяются при обработке металлов, в пищевой промышленности, при изготовлении моющих средств и зубной пасты.
2.1. Даны значения pK для трех
последовательных стадий диссоциации фосфорной
кислоты при 25o C:
pK 1a = 2.12
pK 2a = 7.21
pK 3a = 12.32
Запишите формулу основания, сопряженного с дигидрофосфат-ионом, и рассчитайте для этого основания значение pKb.
Очень часто небольшие количества фосфорной кислоты добавляют в безалкогольные напитки типа "Колы" для придания напиткам кислого или терпкого привкуса. "Кола" (плотность 1.00 г/мл) содержит 0.050 мас.% фосфорной кислоты.
2.2. Вычислите pH "Колы" (в расчетах не учитывайте вторую и третью стадии диссоциации фосфорной кислоты). Можно считать, что кислотность среды обусловлена только фосфорной кислотой.
2.3. В сельском хозяйстве фосфорная
кислота используется как удобрение. Фосфорная
кислота концентрацией 1.00![]() 10–3
M добавлена к водной суспензии почвы; обнаружено,
что рН этой суспензии равен 7.00.
10–3
M добавлена к водной суспензии почвы; обнаружено,
что рН этой суспензии равен 7.00.
Вычислите мольную долю каждой из фосфорсодержащих частиц, присутствующих в растворе. При расчетах допустите, что ни один из компонентов почвы не взаимодействует ни с одним фосфоросодержащим компонентом.
2.4 Цинк – важный микроэлемент, который
необходим растениям для роста. Растения могут
поглощать цинк только в водорастворимой форме. В
некотором образце почвенной воды, имеющей pH = 7.0,
единственным источником цинка и фосфата
является фосфат цинка. Рассчитайте концентрацию
ионов Zn2+ и PO43– в данном
растворе. ПР(Zn3(PO4)2) = 9.1![]() 10- 33.
10- 33.
33 МХО Задача 3
Второй закон термодинамики
Второй закон термодинамики относится к фундаментальным законам науки. В этой задаче рассматривается термодинамика идеального газа, фазовых переходов и химического равновесия.
3.00 моль газообразного CO2 расширяются изотермически (в тепловом контакте с окружающей средой, имеющей температуру 15.0 oC) против постоянного внешнего давления 1.00 бар. Начальный и конечный объемы газа равны 10.0 л и 30.0 л, соответственно.
3.1.Выберите правильный ответ для
изменения энтропии системы (![]() Sсис)
и окружающей среды (
Sсис)
и окружающей среды (![]() Sокр)
:
Sокр)
:
(а) |
|
(б) |
|
(в) |
|
(г) |
3.2 Рассчитайте изменение энтропии
системы (![]() "Sсис),
считая CO2 идеальным газом.
"Sсис),
считая CO2 идеальным газом.
3.3.Рассчитайте изменение энтропии
окружающей среды (![]() "Sокр).
"Sокр).
3.4. Рассчитайте изменение энтропии вселенной (система плюс окружающая среда). Находится ли Ваш ответ в согласии со Вторым законом термодинамики?
Ниже приведена схематическая (без соблюдения масштаба) фазовая диаграмма "давление–температура" для CO2 .
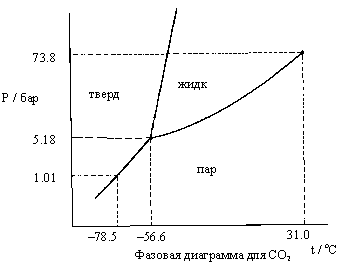
3.5.CO2 (газ), находившийся при начальном давлении 4.0 бара и температуре 10.0оС, охлаждается при постоянном давлении. В этом процессе:
(а) |
Он переходит сначала в жидкую фазу, а затем в твердую |
(б) |
Он переходит сразу в твердую фазу, минуя жидкую |
Выберите правильный ответ.
3.6. При тех же исходных давлении и температуре (см. п. 3.5) CO2 начинают сжимать изотермически. В этом процессе:
(а) |
Он сначала переходит в жидкую фазу, а затем в твердую фазу |
(б) |
Он сразу переходит в твердую фазу, минуя жидкую фазу |
Выберите правильный ответ.
3.7.Из данных, приведенных в фазовой
диаграмме, рассчитайте молярное изменение
энтальпии для процесса сублимации CO2.
Приведите формулу, которую Вы использовали.
3.8CO(г), широко использующийся в органическом синтезе, может быть получен взаимодействием CO2(г) с графитом. Используя приведенные ниже данные, покажите, что при стандартных условиях (298.15 K) константа равновесия меньше единицы.
CO2(г): ![]() fHo =
- 393.51 кДж/моль; So = 213.79 Дж/(K* моль)
fHo =
- 393.51 кДж/моль; So = 213.79 Дж/(K* моль)
CO(г): ![]() fHo = - 110.53
кДж/моль; So = 197.66 Дж/(K* моль)
fHo = - 110.53
кДж/моль; So = 197.66 Дж/(K* моль)
C(графит): So = 5.74 Дж/(K* моль)
3.9. Вычислите температуру, при которой приведенная выше реакция имеет константу равновесия, равную единице. При проведении расчетов считайте стандартные термодинамические величины не зависящими от температуры.
3.10.Приведенная выше реакция (см. п. 3.8) проводится между CO2 и избытком горячего графита в реакторе, в котором поддерживается температура 800oC и общее давление 5.0 бар. Константа равновесия Kp для этих условий равна 10.0. Рассчитайте парциальное давление CO в равновесной системе.
33 МХО Задача 4
Индийский минерал
Минерал монацит, который в больших количествах входит в состав пляжного песка в индийском штате Керала, богат торием. Типичный образец монацита содержит около 9% ThO2 и 0.35% U3O8. Изотопы свинца 208Pb и 206Pb – стабильные конечные продукты серий радиоактивного распада, которые начинаются с 232Th и 238U, соответственно. Весь свинец (Pb), входящий в состав монацита, имеет радиогенную природу.
Соотношение атомов изотопов 208Pb/232Th
в образце монацита, измеренное
масс-спектрометрически, равно 0.104. Периоды
полураспада 232Th и 238U равны 1.41![]() 1010 лет и 4.47
1010 лет и 4.47![]() 109
лет, соответственно. Считайте, что все время с
момента образования минерала атомы 208Pb, 206Pb,
232Th и 238U не выделялись из образца
монацита.
109
лет, соответственно. Считайте, что все время с
момента образования минерала атомы 208Pb, 206Pb,
232Th и 238U не выделялись из образца
монацита.
4.1 Рассчитайте возраст образца монацита (с момента его образования).
4.2 Рассчитайте соотношение атомов изотопов 206Pb/238U в образце монацита.
4.3 Торий-232 – важный материал для ядерной
энергетики. При облучении тепловыми нейтронами
каждый атом тория поглощает один нейтрон и затем
образующийся изотоп через последовательность ![]() – распадов превращается в 233U.
Напишите уравнения ядерных реакций, протекающих
при превращении 232Th в 233U.
– распадов превращается в 233U.
Напишите уравнения ядерных реакций, протекающих
при превращении 232Th в 233U.
При ядерном делении 233U образуется сложная
смесь радиоактивных продуктов. Один из продуктов
– 101Mo – претерпевает радиоактивный распад
в соответствии со схемой:
![]()
4.4 Свежеприготовленный радиохимически чистый образец 101Mo содержит 50000 атомов 101Mo в начальный момент времени. Сколько атомов изотопов
будет находиться в данном образце через 14.6 мин?