Задача N 1.
Для подражателей закрыт высокой
страсти путь,
Одним безумцам по нему идти разрешено.
Низами.
Безводный хлорид металла (вещество А) массой 2,0 г растворили в 50 мл этилацетата, после чего в раствор медленно ввели оксид азота (IV). Каждое добавление сопровождалось энергичным выделением окрашенного газа Х. Добавление продолжали до тех пор, пока не прекратилось выделение Х.
Полученный раствор нагревали в вакууме до 40-50oС и к образовавшейся вязкой смолистой массе добавили еще 100 мл N2O4, что привело к выделению бледно-желтых кристаллов вещества I. Результаты термического анализа I, проведенного в вакууме, представлены в таблице:
| Температура, oС | 70 |
95 |
125 |
| Потеря массы, % | 29,0 |
58,0 |
66,6 |
| Образующееся соединение | II |
III |
IV |
Дальнейшим нагреванием IV на воздухе можно получить 0,63 г белого порошка Б.
Для определения молярной массы IV 1,00 г его
растворили в 100 мл диоксана и измерили
температуру замерзания полученного раствора.
Понижение температуры замерзания раствора
составило ![]() to = 0,113
to = 0,113 ![]() 0.005oС (по сравнению с чистым
растворителем).
0.005oС (по сравнению с чистым
растворителем).
Свойства диоксана:
плотность – 1,036 г/мл;
криоскопическая константа – 4,76 град.
моль/кг.
Вопросы:
1. Определите состав веществ А и Б
2. Установите состав соединений I-IV и газа
Х.
3. Напишите уравнения протекающих реакций
(синтеза и термолиза).
4. С какой целью в синтезе был использован
этилацетат?
5. Предложите структурные формулы веществ I, III, IV
(попробуйте нарисовать пространственное
строение).
6. Предложите еще два способа получения вещества III
(уравнения химических реакций).
7. Как получить безводный хлорид А, исходя из
металла или вещества Б (уравнения химических
реакций)?
Задача N 2.
Эй, встряхнись, кто застыл, у кого
сонный вид!
Посмотри: чудеса наука творит.
Аббас Сиххат.
Известно, что триметилалюминий в газовой фазе существенно димеризован. С ростом температуры степень диссоциации димера увеличивается. В 1942 г. К.Джильям определил значения констант диссоциации димера, которые составили:
Т, oС |
100 |
115 |
156 |
Кр |
2,88. 10-3 |
7,67. 10-3 |
9,31. 10-2 |
Установлено, что триметилалюминий легко образует летучие комплексы, например с триметиламином. В одной из научных работ для молекул триметилалюминия, триметиламина, ионов тетраметилалюмината и тетраметиламмония, а также аддукта триметилалюминия с триметиламином приводятся следующие значения межатомных расстояний Al–C и C–N (мы приводим эти значения в порядке возрастания): 1,454; 1,474; 1,499; 1,957; 1,987; 2,023 Е.
Вопросы:
1. Приведите структурные формулы, наглядно изображающие геометрическое строение указанных выше мономерных частиц. В формулах укажите длины связей Al–C и N–C, выбрав их из приведенного выше ряда. Укажите также величины валентных углов.
2. Приведите структурную формулу димера триметилалюминия. Оцените значения межатомных расстояний в этой структуре.
3. Оцените энтальпию диссоциации димера
триметилалюминия в указанном интервале
температур. Для расчета используйте
интегральную форму уравнения изобары Вант-Гоффа:
lnK2/K1 = -![]() Ho (1/T2
- 1/T1)/R.
Ho (1/T2
- 1/T1)/R.
4. Рассчитайте степень диссоциации димера и плотность пара триметилалюминия при 156 єС и давлении 1 атм.
5. При какой температуре константа равновесия диссоциации будет равна 1?
6. Как Вы думаете, при какой температуре диссоциацию димера можно считать практически полной? Ответ обоснуйте.
Задача N 3.
И чем работа жарче и трудней,
Тем больше у него охоты к ней.
Мирза-Алекпер Сабир.
Растворимость иода в воде при различных температурах может быть с хорошей точностью описана зависимостью:
0 –50o С [I2] = 0,144 + 0,0038. t + 1,48. 10-4. t2 ([I2] - г/л H2O)
50 – 100oС [I2] = 2,96 - 0,104. t + 1,19. 10-3. t2 ([I2] - г/л H2O)
Для иода энтальпии плавления и испарения
составляют ![]() Ho298 = 15,27
кДж/моль ;
Ho298 = 15,27
кДж/моль ; ![]() Hє298 = 41,67
кДж/моль соответственно.
Hє298 = 41,67
кДж/моль соответственно.
В водных растворах солей и кислот растворимость иода может существенно меняться в зависимости от состава и концентрации. Для многих растворов эта зависимость имеет линейный вид:
[I2] = A + B. [YX],
где [I2] - концентрация растворившегося иода, моль/л; Y = H, Na, K; X=Cl, Br, I.
YX |
t, oC |
концентрация YX, M |
A |
B |
HCl |
25,4 |
0,5 - 4 |
0,000066 |
0,00173 |
HBr |
25,0 |
0,5 - 4 |
-0,0041 |
0,0206 |
HI |
25,2 |
0,01-0,3 |
-0,0031 |
0,536 |
HI |
25,2 |
0,3 - 0,6 |
-0,053 |
0,71 |
NaCl |
25 |
0,1 -1,25 |
0,0024 |
0,0023 |
NaCl |
25 |
3 -5,5 |
0,0083 |
-0,00057 |
NaBr |
25 |
1 - 3 |
0,006 |
0,0081 |
NaI |
25 |
0,03 - 0,16 |
-0,00016 |
0,59 |
KCl |
25 |
0,25 - 3 |
0,0024 |
0,0021 |
KBr |
25 |
0,5 - 5 |
0,0051 |
0,011 |
KI |
25 |
0,01 - 0,1 |
0,0013 |
0,50 |
KI |
7,9 |
0,01 - 0,5 |
-0,20 |
0,59 |
KI |
7,9 |
0,5 - 0,8 |
-0,12 |
0,78 |
В 1989 г. в МИТХТ им. М.В.Ломоносова была изучена растворимость иода в растворах, содержащих иодиды двухвалентных металлов. Оказалось, что на растворимости иода существенно сказывается присутствие в растворе иодидов, например, марганца или кобальта, и почти не сказывается наличие иодида кадмия. В случае иодида марганца отношение в растворе I2 : I- достигает значения 1,45 : 1, во всех остальных случаях – существенно меньше этой величины (1,1 – 1,3).
Вопросы:
Задача N 4.
...Меж серых гор и в мареве степей,
В пустыне знойной в даль она течет...
Самед Вургун.
"Битумные сланцы, асфальт, нефтеносные слои всегда богаты ураном. Для нефти установлены средние значения порядка 100 г урана на тонну нефти." М.Н.Гайсинский, "Ядерная химия и ее приложения", Издатинлит, М., 1961 г, стр.300.
Природный уран состоит, в основном, из двух
изотопов: 23892U – 99,3% и 23592U
– 0,7% с периодами полураспада 4,5. 109
лет и 7,1. 108 лет, соответственно. И тот
и другой изотопы урана являются
родоначальниками радиоактивных рядов. Один из
рядов оканчивается стабильным изотопом свинца 20782Pb,
другой – стабильным изотопом 20682Pb.
Поскольку нефть образовалась достаточно давно,
можно считать, что между изотопами урана и
остальными радиоактивными нуклидами – членами
соответствующего ряда установилось "вековое
равновесие": радиоактивность урана a(U) = N(U).
![]() (U) равна радиоактивности
каждого члена ряда, т.е.: N(U).
(U) равна радиоактивности
каждого члена ряда, т.е.: N(U). ![]() (U) = Ni.
(U) = Ni. ![]() i.
Здесь Ni – число атомов соответствующего
радиоактивного нуклида в текущий момент времени
и
i.
Здесь Ni – число атомов соответствующего
радиоактивного нуклида в текущий момент времени
и ![]() i – константа скорости
распада этого нуклида. Во время транспортировки
нефти морем танкер попал в аварию и получил
пробоины. Примите для определенности, что в море
вытекло 106 т нефти.
i – константа скорости
распада этого нуклида. Во время транспортировки
нефти морем танкер попал в аварию и получил
пробоины. Примите для определенности, что в море
вытекло 106 т нефти.
Вопросы:
1. Рассчитайте содержание каждого из изотопов
урана в вылившейся нефти
2. Рассчитайте константы скорости распада
изотопов урана. Примите, что в году 365 дней.
3. Рассчитайте число радиоактивных нуклидов,
включая изотопы урана, в каждом радиоактивном
ряду.
4. Рассчитайте суммарную радиоактивность (в
единицах Кюри), которая попала в воду вместе с
нефтью. Напомним, что радиоактивный распад
описывается уравнением кинетики 1-го порядка. 1
Кюри (Ku) = 3,7. 1010 Бк и 1 Бк = 1 распад/сек.
5. Кюри – внесистемная единица радиоактивности.
Первоначальное определение Кюри связывали с
массой радия–226, в которой происходит 3,7. 1010
расп/с. Если взять значение Т1/2,
определенное на тот момент времени, то получим: m(226Ra)
= 1 г. С уточнением периода полураспада
радия–226, от этого определения отказались, хотя
его можно использовать для приближенных
расчетов.
Какое суммарное количество радия в граммах: 226Ra(T1/2
= 1620 лет) + 223Ra(T1/2 = 11,2 дня) попало в воду?
6. Как Вы думаете, в какой (каких) фракциях
концентрируется уран при переработке сырой
нефти?
Задача N 5.
Мир тебе не потатчик.
С тобою идет он не в ногу
От него отойди,
Отыщи ты другую дорогу.
Низами.
Легкокипящий углеводород А (toкип 41oС) выделяют из фракций пиролиза нефтяного сырья и коксования угля, кипящих выше 150oС. Углеводород Б, гомолог вещества А, был получен в результате многостадийного синтеза из вещества С, молекулярная формула которого С5Н10Вr2 (Роуз, 1961)
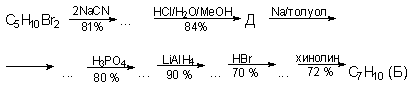
В реакции с малеиновым ангидридом А дает два изомера: I (98,5%) и II (1,5%), причем при повышении температуры доля II увеличивается.
Вопросы:
Задача N 6.
Гремит нередко мудрость простотой
И слепо тянется за красотой
И красота порой совета мудрых
Не слышит в простоте святой.
Мирза-Шафи Вазех.
В 1856 году Дж.Барлоу впервые осуществил нитрование п-цимола (пара-изопропилтолуола). В статье, опубликованной в немецком химическом журнале "Annalen der Chemie", автор писал, что ему удалось получить "маслянистую жидкость, достаточно чистую для анализа." По данным Дж.Барлоу полученное им соединение имело состав С20Н13NO4. В двадцатом столетии эта реакция неоднократно изучалась различными группами химиков. В 1974 году два американских исследователя из сиракузского университета (Нью-Йорк) Роджер Хан и Дэвид Страк, подробно исследуя эту реакцию, установили, что нитрование п-цимола нитрующей смесью (HNO3+H2SO4) при 25oС приводит к образованию смеси п-нитротолуола (выход 11%) и двух изомерных соединений с молекулярной формулой С10H13NO2 (изомер А - выход 82%, изомер В - 7%). При низкотемпературном (0 o С) нитровании п-цимола с использованием в качестве нитрующего агента 100%-ной азотной кислоты в уксусном ангидриде в дополнение к п-нитротолуолу (10%) и изомерам А и В (41% и 8%, соответственно) удалось выделить еще два изомерных некристаллизующихся соединения С и D (суммарный выход 41%) состава С12H17NO4 (согласно частному сообщению профессора А.Фишера, проведение этой реакции при -15 oС увеличивает выход С и D до 55%). Гидролиз смеси С и D действием 78%-ной серной кислоты при комнатной температуре приводит к образованию только одного вещества А, а при 155oС (в условиях препаративной газо-жидкостной хроматографии) образуется смесь исходного п-цимола и соединения F, С12Н16О2.
Вопросы:
Задача N 7.
Красу не оценить
Неискушенным глазом,
Алмазы огранить
Возможно лишь алмазом.
Мирза-Шафи Вазех.
Образец индивидуального органического соединения Х состава С6Н10О, массой 1 г, растворен в 20 мл тяжелой воды. К раствору добавлено небольшое количество гидроксида тетраметиламмония, и полученный раствор выдержан при комнатной температуре в течение длительного времени (реакция 1). Затем к раствору добавлено 25 г карбоната калия. Реакционную смесь экстрагировали эфиром, объединенные экстракты высушили безводным сульфатом магния, эфир отогнали и оставшуюся жидкость подвергли масс-спектрометрическому исследованию. В масс-спектре обнаружены пики ионов с m/e, равными 98, 99, 100, 101, 102, 103, 104 c соотношением интенсивностей соответственно 2 : 4 : 14 : 42 : 146 : 17 : 3
Вещество Х оптически недеятельно, а при взаимодействии с (+)-D-бутандиолом-2,3 образует одно оптически активное вещество A (реакция 2).
Каталитическое гидрирование Х в избытке водорода при 20-30 oС дает два вещества B и C в соотношении 7 : 3, а при 160-180 oС приводит к двум другим соединениям - D и E примерно в равных количествах (реакции 3 и 4).
Вопросы:
1. Предложите все структурные формулы соединений, удовлетворяющих условиям реакции 1.
2. Обсудите для каждого из изомеров поведение в реакциях 2 - 4 .
Результаты обсуждения представьте в виде таблицы:
Структурные формулы изомера |
Реакция 2 |
Реакция 3 |
Реакция 4 |
В первой вертикальной колонке приведите структурные формулы изомерных соединений, а в трех остальных цифрой укажите число веществ, образующихся для каждого изомера в реакциях 2 - 4 соответственно.
3. Выберите однозначно структуру Х. Изобразите пространственное строение молекул Х, A, B и С. Объясните отнесение структур B и С.
4. Назовите соединения D и E по систематической номенклатуре.