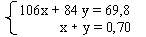Школьные олимпиады по химии
LX Московская городская олимпиада школьников по химии
Городской этап
2003/2004 уч. год
Задания 9 класса
9-1Красящий пигмент оранжевой краски –
свинцового сурика – имеет состав Pb3O4.
1. Какова возможная степень окисления свинца в
этом соединении?
2. К какому классу химических соединений можно
отнести это вещество?
3. При взаимодействии свинцового сурика с углем
можно получить металлический свинец. Напишите
уравнение реакции.
4. Сколько г свинца можно получить из 6,85 г сурика,
если выход реакции от теоретически возможного
составляет 97%?
9-2 Вещество массой 14,9 г, образованное двумя
видами химических частиц с одинаковым
электронным строением 1s22s22p63s23p6,
полностью прореагировало с 20,0 г 98%-ной серной
кислоты.
1. Напишите уравнение реакции.
2. Определите массу образовавшейся соли.
3. Напишите уравнение реакции водного раствора
образовавшейся соли с металлическим магнием.
9-3 При взаимодействии водных растворов,
содержащих 36,5 г хлороводорода и 40 г гидроксида
натрия, выделилось 57 кДж тепла.
1. Напишите полные и сокращенные ионные уравнения
реакций.
2. Сколько тепла выделится при взаимодействии 150 г
10%-ного раствора серной кислоты и 50 г 11,2%-ного
раствора гидроксида калия?
9-4 Если к твердому нитрату натрия добавить
концентрированную фосфорную кислоту, то при
нагревании смеси из нее можно отогнать азотную
кислоту.
1. Напишите уравнение реакции (фосфорная кислота
в избытке).
2. Означает ли данный эксперимент, что фосфорная
кислота сильнее азотной?
3. Можно ли получить азотную кислоту при реакции
30%-ных растворов азотнокислого натрия и
фосфорной кислоты?
9-5 При взаимодействии 69,8 г смеси
карбоната и гидрокарбоната одного и того же
щелочного металла с соляной кислотой выделяется
30,8 г оксида углерода (IV).
Определите щелочной металл и массы солей в
исходной смеси.
9-6 В сосуде при 300 К (градусах абсолютной
температуры) и давлении 2 атм содержится 1 моль
водорода и 1 моль хлора. После освещения смеси
ультрафиолетом и окончания реакции температура
сосуда составила 600 К.
1. Напишите уравнение реакции.
2. Почему эта реакция может начаться при
освещении?
3. Какой процесс является первой стадией реакции
при освещении?
4. Какое давление (атм) было в сосуде при измерении
температуры после окончания реакции?
5. Сколько г хлороводорода содержится в сосуде
после окончания реакции?
РЕШЕНИЯ
9-1. 1) Pb2PbO4 - степени
окисления +2 и +4 или (не совсем верное, но
оценивается) Pb(PbO2)2 Степени окисления
свинца +2 и +3
2) Это свинцовая соль свинцовой (свинцовистой)
кислоты
3) Pb3O4 + 2 C = 3 Pb + 2 CO2
4) 6,85 г составляет 0,01 моль сурика; из него
получится 0,01 моль или 6,21 г свинца. С учетом
выхода 6,21 г свинца х 0,97 = 6,02 г
9-2. Электронному строению
соответствуют KCl, CaS, ScP и сочетания этих катионов
и анионов.
20 г серной кислоты соответствуют 20/98 = 0,204 моль
Тогда 14,9 г соответствует 0,2 или 0,4 моль соли.
Подходит KCl (74,5)
14,9 г CaS соответствуют 0,207 моль соли; из него с
серной кислотой образуется только CaSO4,
почти не растворимый в воде и не реагирующий в
растворе с магнием. 14,9 г ScP соответствуют 0,196 моль
соли; при этом серная кислота в недостатке.
Формально подойдет K2S - получится
средний и кислый сульфат.
По 0,2 моль KCl и H2SO4
1) KCl + H2SO4 = HCl + KHSO4
2) Получится 0,2 моль или 27,2 г кислой соли
3) 2 KHSO4 + Mg = K2SO4 + MgSO4 + H2
9-3. 1) HCl + NaOH = NaCl + H2O
H+ + OH– = H2O
Тепловой эффект относится к реакции
нейтрализации: H+ + OH– = H2O + Q
2) 36,5 г хлороводорода и 40 г гидроксида натрия
составляют по 1 моль, т.е. тепловой эффект реакции
нейтрализации Q = 57 кДж/моль. В 150 г 10%-ного
раствора 15 г серной кислоты, или более 0,15 молью
В 50 г 11,2%-ного раствора 5,6 г гидроксида калия или 0,1
моль. Серная кислота в избытке, расчет по КОН
На 0,1 моль образующейся при нейтрализации воды
выделится 57х0,1 = 5,7 кДж
9-4. 1) H3PO4 + NaNO3 = NaH2PO4
+ HNO3 (при нагревании)
2) Сила кислоты определяется ее способностью
диссоциировать в водном растворе, а в описанной
реакции равновесие сдвигается вправо за счет
разной летучести кислот, но не их силы. Т.е.
фосфорная кислота может быть и слабее азотной
(так оно и есть на самом деле).
3) В водном растворе в равновесии будут
находиться несколько ионов. Поскольку при
реакции не выделяется газ, не образуется осадок
или вода, азотную кислоту в этом случае
получить нельзя.
9-5. 1) Реакции в общем виде: MHCO3 + HCl =
MCl + CO2 + H2O
M2CO3 + 2 HCl =2 MCl + CO2 + H2O
2) Видно, что для получения 1 моль CO2
требуется больше по массе карбоната, чем
гидрокарбоната. Количество CO2 составляет
30,8/44 = 0,7 моль. Если 69,8 г представлял бы собой
чистый гидрокарбонат (0,7 моль MHCO3), то
условная атомная масса щелочного металла
составила бы: (69,8 /0,7) - 61 = 99,7 - 61 = 38,7
Аналогично для чистого карбоната получим: (99,7 -
60)/2 = 19,9
Следовательно, у нас смесь карбоната и
бикарбоната щелочного металла с атомной массой
между 19,9 и 38,7 - подходит только натрий.
3) Теперь получаем систему из двух уравнений с
двумя неизвестными:
Для Х моль Na2CO3 (106) и У моль NaHCO3
(84) запишем
106Х + 84У = 69,8
Х + У = 0,7
Решая систему, получаем: Х = 0,5; У = 0,2
Ответ: 0,5 моль Na2CO3 (53,0 г); 0,2 моль
NaHCO3 (16,8 г) (дубль: авторское решение
(А.Е.Леонтьев):
Суммарная стехиом. схему по углероду: х Ме2СО3
+ у МеНСО3 = (х + у) СО2
М(Ме2СО3) = 2а + 60
М(МеНСО3) = а + 61
n(CO2) = 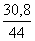 =
0,70 моль
=
0,70 моль
Получаем систему двух уравнений с тремя
неизвестными.
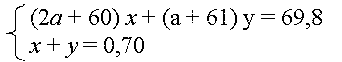
Поскольку суммарные количества вещества в
обеих частях стехиометрической схемы равны (х +
у), можно определить числовое значение средней
молярной массы смеси солей.
М = 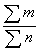 =
= 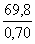 = 100 г/моль
= 100 г/моль
Предположим, что система состоит только из
одного вещества: либо Ме2СО3, либо
МеНСО3. В таком случае должно выполняться
соответственно одно из равенств.
Для Ме2СО3: 2а + 60 = 100, отсюда а = 20
Для МеНСО3: а + 61 = 100, отсюда а = 39
Допущение позволило найти левую и правую границу
промежутка, в котором содержится искомое
значение а. Получаем двойное неравенство: 20 < а
< 39
Значение а (атомной массы металла) лежит в
промежутке [20; 39]. Условиям задачи удовлетворяет
только одно значение: а = 23, т. е. искомый металл –
натрий.
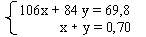
Отсюда х(Na2СО3) = 0,50 моль, у(NaНСО3)
= 0,20 моль.
m(Na2СО3) = 0,50 * 106 = 53,0 г
m(NaHСО3) = 0,20 * 84 = 16,8 г
9-6. 1) H2 + Cl2 = 2 HCl
2) Это цепная реакция, которую инициирует свет,
вызывающий распад молекулы хлора на атомы: Cl2® [hn] ® 2
Cl.
3) Затем идет реакция: H2 + Cl. = HCl + H.
Цепь продолжают атомы водорода: H. + Cl2
= HCl + Cl.
4) В ходе реакции объем газа не меняется,
следовательно изменение давления может быть
связано только с изменением температуры газа: P1/T1
= P2/T2 ; P2 = P1T2/T1 .
Тогда P2 = 2*600/300 = 4 (атм)
5) Из 1 моль водорода и 1 моль хлора получится 2 моль
HCl: 36,5*2 = 73 г


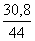 =
0,70 моль
=
0,70 моль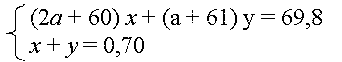
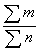 =
= 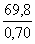 = 100 г/моль
= 100 г/моль