
|
|
Школьные олимпиады по химии
LX Московская городская олимпиада школьников по химии
Городской этап
2003/2004 уч. год
Задания 11 класса
Предисловие
К сожалению, в ходе окончательного набора, в
задаче №6 была допущена опечатка, которая
сделала адекватное решение этой задачи
невозможным. Куратор 11 класса приносит извинения
за эту досадную ошибку. Решения этой задачи
участниками проверялись на основании логики их
рассуждений и наличия разумных предположений. В
настоящем комплекте эта ошибка исправлена.
11-1 Образец сплава цинка с алюминием
массой 10,0 г растворили в избытке соляной кислоты.
При этом выделилось 7,03 л газа (приведено к н.у.).
Определите массовые доли металлов в сплаве.
Какое количество газа выделится при растворении
того же сплава в горячем растворе
концентрированной щелочи?
11-2 При бромировании некоторого
ароматического соединения в присутствии
катализатора AlBr3 в темноте образуется
только одно монобромпроизводное, причем из 1,00 г
исходного соединения можно получить 1,57 г этого
монобромпроизводного.
Определите строение описанных органических
веществ, если известно, что выход продукта
реакции составляет 90%.
11-3 Навеску 3.07 г соединения Д
растворили в избытке водного раствора NaOH.
Полученный раствор нейтрализовали азотной
кислотой до pH=7 и добавили избыток нитрата
кальция. Выпавший белый осадок отфильтровали,
высушили и взвесили – его масса составила 3,1 г. К
оставшемуся раствору добавили избыток нитрата
серебра, что вызвало выпадение еще 8,61 г белого
осадка.
Определите вещество Д и напишите уравнения
всех реакций упомянутых в задаче. Какие вещества
могут образовываться при реакции Д с
аммиаком?
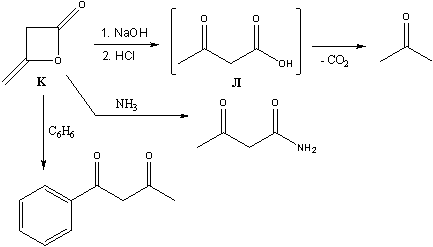
11-4 Вещество К является летучей
жидкостью с плотностью паров по водороду 42. При
обработке К разбавленным раствором NaOH и при
последующем подкислении образуется
неустойчивая кислота Л, которая далее легко
декарбоксилируется давая ацетон.
Определите вещества К и Л. Как можно
получить вещество К в промышленности и
лаборатории? Приведите реакции вещества К
с:а) аммиаком (молярная масса продукта равна 101
г/моль)
б) бензолом в присутствии хлорида алюминия
(молярная масса продукта равна 162 г/моль).
11-5 Разбираясь на старых полках в
лаборатории химики обнаружили белое
кристаллическое вещество. Вещество хорошо
растворялось в воде образуя кислый раствор. При
добавлении к раствору 1,00 г этого вещества по
каплям раствора AgNO3 образовалось 2,73 г
белого творожистого осадка. При дальнейшем
добавлении AgNO3 наблюдается выпадение
черного осадка и выделение газа с плотностью по
водороду 14.
Определите, какое вещество нашли химики и
напишите уравнения его реакций с AgNO3.
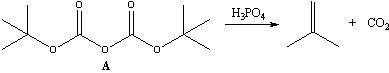
11-6 Органическое вещество А при
слабом нагревании в концентрированной фосфорной
кислоте разлагается, образуя смесь газов с
плотностью по водороду 25, причем в растворе не
остается органических веществ. Если
образовавшуюся смесь газов пропустить через
бромную воду, то ее объем уменьшается вдвое, а при
последующем пропускании через раствор щелочи ее
остаток поглощается полностью. Определите
вещество А, если известно, что атомы водорода
в нем неразличимы. Напишите уравнения упомянутых
реакций. Предложите способ получения вещества А.
Для каких целей вещество А широко
используется в органическом синтезе? Приведите
пример.
ОТВЕТЫ
"…I didn't say it would be easy. I just said it would be the
truth…"
Morpheus, The Matrix
- w(Zn) = 60%
w(Al) = 40% (колебания в пределах 2%
принимаются за правильный ответ)
При растворении в щелочи выделится 14,06 л (0,626 моль)
газа.
- Ароматическое соединение – п-ксилол
(молярная масса = 106),
продукт бромирования – 1-бром-2,5-диметилбензол
(молярная масса = 185)
- Вещество Д – POCl3 (молярная масса = 153,5)
Продукты реакции Дc аммиаком могут быть
такие:
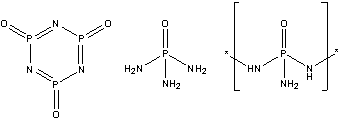
 - Обнаруженное вещество – дигидрохлорид
гидразина N2H6Cl2 (молярная масса
катиона = 17*n, где n – число атомов хлора).
Реакции:
N2H6Cl2 + 2AgNO3 = N2H6(NO3)2
+ 2AgCl
N2H6(NO3)2 + 4AgNO3 = 4Ag + 6HNO3
+ N2
- Реакция
Получение
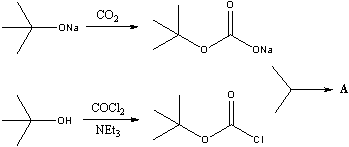
A (распространенное сокращение – Boc2O)
используется в качестве защиты спиртовых групп в
органическом синтезе.
РЕШЕНИЯ
- Запишем уравнения реакции растворения металлов
в кислоте:
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
Пусть x – массовая доля цинка в сплаве, а y –
массовая доля алюминия. Тогда можно составить
систему уравнений:
x + y = 1
10*x/65 + (10*y/27)*3/2 = 7,03/22,4
Решая ее получаем ответ: w(Zn) = 60%; w(Al) = 40%
Для того, чтобы определить сколько водорода
выделится при растворении 20,0 г этого сплава в
щелочи, не обязательно проводить расчет.
Поскольку растворение как в кислоте, так и в
щелочи является по сути восстановлением
водорода, то объем выделившегося газа на массу
металла не изменится. Следовательно при
растворении 20,0 г выделится вдвое большее
количество водорода – 14,06 л.
- Молярная масса ароматического соединения в
результате реакции бромирования изменяется
следующим образом:
M(монобромпроизводного) = М(соединения) + 80(бром) –
1(замещенный водород)
Обозначим молярную массу ароматического
соединения за x и составим уравнение:
1,57*0,9/(x + 80 - 1) = 1,00/x
Откуда x = 106.
Среди производных бензола этой молярной массе
соответствуют этилбензол, ксилолы и
бензальдегид. Из этих веществ только одно
монобромпроизводное могут образовывать пара-ксилол
(вследствие эквивалентности всех положений) и
бензальдегид (вследствие преимущественного
замещения в мета-положения). Однако,
значительная часть бензальдегида окисляется при
бромировании в указанных условиях, а также
образуются (в меньших количествах) орто- и пара-бромзамещенные
продукты. Поэтому максимальный балл в этой
задаче ставился за ответ пара-ксилол.
- Осадок выпавший при добавлении нитрата серебра
вероятно – AgCl. Представим вещество Д
формулой AClx. Тогда молярная масса А равна:
M(A) = 3,07/(8,61/x*143,5) – 35,5*x = x*(3,07/(8,61/143,4) – 35,5)
где 143,5 - молярная масса AgCl. Отсюда находим А = 47 и x
= 3 (при других x получаются не целочисленные
значения A).
Осадок выпавший при добавлении нитрата кальция
может быть фторидом, карбонатом или фосфатом
(сульфат кальция выпадает только при нагревании
раствора). Таким образом А должно содержать C, F
или P. Разумный ответ получается только при
последнем варианте – A = PO. Таким образом Д = POCl3.
При реакции Д аммиаком наиболее вероятно
замещение атомов хлора (кислород более прочно
связан с фосфором).
- Кислота, которая при декарбоксилировании
образует ацетон - CH3C(O)CH2COOH
(ацетоуксусная кислота). Она имеет молярную массу
102 г/моль, что отличается от молярной массы
вещества К (42*2=84) на 18 г/моль, то есть на
молекулу воды. Отщепляя молекулу воды от
ацетоуксуной кислоты можно получить следующие
структурные формулы:
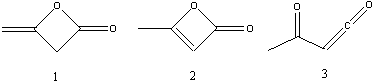
Формулы 1 и 2 по сути могут являться таутомерами.
Формула 3 является менее предпочтительно,
поскольку содержит нестабильный алленовый
фрагмент. Верная структура вещества К,
определить которую можно опираясь в основном на
знания, формула 1 – дикетен. Получают дикетен
димеризацией кетена CH2=C=O, а его в свою
очередь – отщеплением HCl от хлорангидрида
уксусной кислоты CH3COCl под действием
третичных аминов (в лаборатории) или пиролизом
самой уксусной кислоты (в промышленности).
Основным направлением реакций дикетена является
нуклеофильная атака по карбонильной группе.
Реакции с аммиаком и бензолом протекают именно
по такому механизму, что и объясняет строение
продуктов (см. ответы).
- Белый творожистый осадок, образовавшийся после
прибавления нитрата серебра – опять-таки AgCl. По
формуле аналогичной приведенной в решении
задачи 3 находим молярную массу катиона A
исследуемого вещества:
M(A) = x*(1,00/(2,73/143,4) – 35,5), M(A) = 17*x
Прибавлении избытка AgNO3 к раствору
очевидно происходит окисление (выпадает осадок
серебра) имеет молярную массу
14*2 = 28. Это может быть СО, N2 или С2H4.
Сопоставляя с молярной массой катиона, находим
подходящее решение для исследуемого вещества – N2H6Cl2
дигидрохлорид гидразина. Катион имеет молярную
массу 34 = 17*2, а при окислении образует азот.
- Органическое вещество А при слабом
нагревании в концентрированной фосфорной
кислоте разлагается, образуя смесь газов с
плотностью по водороду 25, причем в растворе не
остается органических веществ. Если
образовавшуюся смесь газов пропустить через
бромную воду, то ее объем уменьшается вдвое, а при
последующем пропускании через раствор щелочи ее
остаток поглощается полностью. Определите
вещество А, если известно, что атомы водорода
в нем неразличимы. Напишите уравнения упомянутых
реакций. Предложите способ получения вещества А.
Для каких целей вещество А широко
используется в органическом синтезе? Приведите
пример.
Смесь газов образующаяся при разложении A
имеет молярную массу 25*2=50 г/моль, причем один из
газов вероятно является алкеном или алкином
(поглощается бромной водой), а второй - CO2
(поглощается щелочью). Зная, что соотношение
газов в смеси 1:1 (объем уменьшается вдвое при
пропускании через бромную воду), найдем молярную
массу первого газа:
М(газа) = 50*2 – 44 = 56, что соответствует молярной
массе бутена.
Учитывая то, что в исходном соединении все атомы
водорода должны быть эквивалентны, разумно
предположить, что в ней содержатся трет-бутильные
заместители, а газ, соответственно, является
изобутиленом. Он, в свою очередь, может
образовываться при дегидратации трет-бутилового
спирта. Комбинацией фрагментов СО2 и (CH3)3CO-
получаем формулу вещества А - Boc2O:

|
|
 |







