 |

|
|
[ На предыдущий раздел]
Метод обратного осмоса хорошо известен [1–3] и относится к весьма эффективным способам глубокой очистки загрязненных вод. В то же время для некоторых областей водоочистки (например, при очистке токсичных и радиоактивных вод или при выделении ценного компонента водного раствора) не меньшее значение, чем степень очистки воды, имеет степень концентрирования примесей в концентрате.
Концентрирование примесей обратным осмосом имеет пределы, связанные с возрастанием осмотического давления концентрируемого раствора, а, следовательно, со снижением движущей силы процесса, которая, в первом приближении, представляет собой разность приложенного к раствору давления, Dp, и осмотического давления раствора, p. При выравнивании приложенного и осмотического давлений удельная проницаемость мембраны, G, стремится к нулю, в соответствии с известным приближенным уравнением [1]:
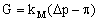 (1), (1),
где k M – константа проницаемости воды, связанная со свойствами мембраны и температурой раствора. Если учесть, что даже для растворов электролитов типа I–I осмотическое давление не меньше 5–6 МПа уже при концентрации растворов 1 моль/л, а рабочее давление в обратноосмотических аппаратах обычно не превышает 7–10 МПа, то ясно, что предел обратноосмотического концентрирования растворов электролитов близок к 60–80 г/л. На практике концентраты обратноосмотических установок могут иметь еще меньшее солесодержание, так как наряду с задачей концентрирования не меньшее значение имеет задача поддержания высокой производительности процесса.
Нетрудно понять, что простое увеличение рабочего давления в обратноосмотическом аппарате для получения рассолов с солесодержанием 200–300 г/л приводит к значениям рабочего давления до 15–20 МПа даже в случае простых электролитов типа I–I, а в случае электролитов с многозарядными катионами – до 25–30 МПа. Высокие рабочие давления требуют разработки специальной аппаратуры, а, следовательно, могут значительно увеличить стоимость очистки.
Здесь предлагается новый подход к очистке воды баромембранными методами, который позволяет увеличить солесодержание концентратов при относительно низких рабочих давлениях процесса и сохранении преимуществ глубокой очистки воды на тонкопористых мембранах. Такую возможность дает использование схемы многоступенчатого концентрирования примесей в баромембранных аппаратах с мембранами различного типа. На первой стадии используется обратноосмотический аппарат с высокоселективными мембранами, которые на 99–99,9% задерживают любые примеси, а на второй и последующих стадиях в баромембранных аппаратах для доконцентрирования рассола используют низкоселективные тонкопористые мембраны, которые задерживают не более 70–80% примесей (в том числе и ионов).
Удельную проницаемость низкоселективной тонкопористой мембраны в данном случае будет описывать более сложное уравнение, которое учитывает ее неидеальную селективность:
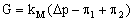 (2), (2),
здесь индексы “1” и “2” относятся к обрабатываемому раствору и пермеату, соответственно .
Удельная проницаемость и селективность тонкопористых мембран зависит от солесодержания обрабатываемого раствора. Ранее [4] были изучены такие зависимости для некоторых отечественных низкоселективных ультрафильтрационных и нанофильтрационных мембран при деминерализации раствора NaCl, однако диапазон концентраций исходного модельного раствора (от 1·10 –4 до 1 моль/л) не охватывал область высокосолевых растворов. Вот почему эти исследования были продолжены.
Основные паспортные свойства изученных мембран представлены в табл. 1. Селективность, f, определяли по традиционному уравнению [1]:
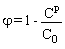 (3), (3),
здесь C p и С0 – концентрация соли в пермеате и исходном растворе, соответственно.
Лабораторная баромембранная установка, использованная для исследований концентрационной зависимости селективности тонкопористых мембран, аналогична установке, описанной в работе [5]. Основным элементом новой установки является проточная баромембранная ячейка с четырехсекционным каналом прямоугольного сечения, которая позволяла исследовать одновременно четыре различных образца мембран ( рис. 1). Рабочая площадь мембраны в каждой секции равна 15 см2.
Концентрацию исходного раствора и пермеата определяли кондуктометрическим способом. Значение рН рабочих растворов определяли на рН-метре. Рабочее давление над поверхностью мембраны создавалось трехплунжерным насосом и в различных опытах составляло от 1 до 7 МПа. Средняя линейная скорость исходного раствора в рабочем канале ячейки достигала более 50 см/с. Температура рабочих растворов 25°С. Диапазон концентраций исходного модельного раствора NaNO 3 от 1·10–2 до 2,4 моль/л.
Экспериментальное изучение зависимостей удельной проницаемости и селективности выбранных мембран ( рис. 2, 3) показало, что мембраны, высокоселективные в области низкосолевых растворов, быстро снижают проницаемость с увеличением солесодержания обессоливаемого раствора, тогда как мембраны с высокой удельной проницаемостью имеют низкую селективность (менее 20%). Исключением из этого правила оказалась мембрана УАМ-100, которая характеризуется низкими значениями и селективности, и удельной проницаемости.
Эксперименты также показали, что проницаемость тонкопористых мембран не равна нулю даже при обессоливании растворов, у которых осмотическое давление в несколько раз превышает избыточное давление над мембраной. В связи с этим было интересно проверить справедливость выражения (2) и установить вид зависимости G = f(DF), где D F = Dp–p1+p2 – движущая сила для переноса растворителя через тонкопористую мембрану.
Результаты обработки экспериментальных данных ( рис. 4) показывают, что уравнение (2) может описывать наблюдаемые зависимости G = f(DF) только при условии весьма сложной зависимости константы проницаемости воды через мембрану, kM, от солесодержания обессоливаемого раствора. В большинстве случаев для каждой отдельной мембраны справедливо следующее уравнение, описывающее зависимость ее удельной проницаемости от движущей силы:
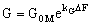 (4), (4),
здесь k G – коэффициент пропорциональности, не имеющий прозрачного физического смысла и с размерностью МПа–1, G0M – константа, которая по физическому смыслу является удельной проницаемостью мембраны в условиях нулевой движущей силы процесса обратного осмоса. Важно подчеркнуть, что она не равна нулю, как это следует из уравнения (2).
Из рис. 4 также видно, что семейство таких зависимостей, в свою очередь, при усреднении образует зависимость, аналогичную уравнению (4), но со значительно большим значением тангенса угла наклона. Для теоретической интерпретации зависимостей G = f(DF), по-видимому, следует развить теорию обратного и капиллярного осмоса в тонкопористых мембранах [6–8] в область высокосолевых растворов. В задачи данной работы такой теоретический анализ не входит, поэтому здесь ограничимся простой констатацией вида наблюдаемых экспериментально зависимостей.
Для растворов электролитов типа I–I в широком диапазоне концентраций осмотическое давление прямо пропорционально концентрации электролита. В случае растворов нитрата натрия прямая пропорциональность сохраняется, по крайней мере, до солесодержания 300 г/л. Другими словами, p i = kpCi, где kp – коэффициент пропорциональности осмотического давления раствора и концентрации электролита. Используем это условие для преобразования уравнения (4) и приведем его к виду:
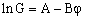 (5), (5),
здесь А = lnG 0M + kGDp – dолжна быть константа при постоянном давлении, а B = kGkpC1 – тангенс угла наклона зависимости (5), величина которого должна изменяться прямо пропорционально концентрации электролита.
Статистическая обработка экспериментальных зависимостей G = f(C 1) для самых различных мембран (табл. 2) при средней концентрации раствора NaNO3 от 4 до 206 г/л показала, что уравнение (5) верно описывает зависимость удельной проницаемости тонкопористых мембран от их селективности. Величина достоверности линейной аппроксимации (R2) при различных концентрациях находится в пределах от 0,786 до 0,973.
Основные результаты проведенной математической обработки ( табл. 2) косвенно указывают на то, что в области концентрации нитрата натрия от 44,5 до 95,5 г/л (или от 0,5 до 1 моль/л) происходит изменение механизма транспорта молекул воды через тонкопористые мембраны. Вероятной причиной этого может являться разрушение слоев связанной воды на поверхности пор мембраны при высоких концентрациях обессоливаемого раствора. Ранее на возможность такого явления указывали Н.В. Чураев и сотр. [9], которые сделали такое предположение на основании исследований течения растворов KCl через поры стеклянной мембраны, изготовленной в виде капилляра. По их предположению слои связанной воды в порах стеклянной мембраны разрушаются при концентрациях растворов KCl выше 1 моль/л (или 74,5 г/л).
Для дальнейших исследований нами была выбрана мембрана типа МГА-70П, выпускаемая ЗАО НТЦ “Владипор” (г. Владимир), как наиболее подходящая для целей высокого концентрирования растворов электролитов. Мембрана типа МГА-70П имеет при солесодержании обессоливаемого раствора около 200 г/л удельную проницаемость 0,5–0,8 м 3/м2·сут и селективность 18–37%. Это, по нашему мнению, та “золотая середина”, которая позволяет реализовать предложенный способ высокого концентрирования растворов электролитов в баромембранных аппаратах.
Экспериментальная проверка стабильности свойств различных участков и партий мембран типа МГА-70П была проведена в лабораторной обратноосмотической установке. Результаты проверки ( рис. 5, 6) показывают, что разброс свойств велик, но не носит катастрофического характера и позволяет получить некоторые усредненные зависимости селективности и удельной проницаемости мембран типа МГА-70П от солесодержания модельного раствора нитрата натрия. Величина достоверности полученных аппроксимаций (R2) находится в пределах от 0,691 до 0,765.
Для мембраны МГА-70П также была определена зависимость селективности от рабочего давления над мембраной при среднем солесодержании модельного раствора нитрата натрия 203,3 г/л. Рабочее давление изменяли в диапазоне от 0,5 до 7 МПа. Мембрану МГА-70П размещали в виде одного образца на всю длину лабораторной четырехсекционной обратноосмотической ячейки, но пермеат отбирали по секциям с различных участков образца. Результаты экспериментов ( рис. 7) показывают, что зависимость селективности мембраны МГА-70П от рабочего давления носит экстремальный характер. Максимальная селективность достигается при 4–5 МПа. При большем рабочем давлении наблюдается снижение селективности.
Экстремальный вид зависимости f = f(Dp) mожно объяснить аргументацией Чураева и Старова, приведенной в работах [7–8]. Суть аргументов сводится к следующему. При низких рабочих давлениях увеличение давления приводит к большей интенсификации переноса молекул воды через обратноосмотические мембраны по сравнению с растворенными веществами. Суммарный эффект этого процесса – рост селективности мембраны. Однако одновременно возрастает и удельная проницаемость мембраны, а, следовательно, и ее концентрационная поляризация. Концентрация растворенных веществ на поверхности мембраны значительно возрастает по сравнению с объемной, это приводит, в свою очередь, к увеличению содержания растворенных веществ в пермеате, а внешне выглядит, как снижение селективности мембраны. Все эти фазы можно наблюдать и в нашем случае (рис. 7).
Проведенное экспериментальное исследование позволяет показать не только принципиальную возможность высокого концентрирования растворов электролитов баромембранными методами, но и проиллюстрировать указанную возможность расчетом некоторых принципиальных схем концентрирования растворов электролитов в баромембранном аппарате (баромембранном концентраторе) на примере нитрата натрия и мембран типа МГА-70П, как наиболее изученных экспериментально.
Будем рассматривать три основных альтернативных варианта баромембранного концентрирования растворов электролитов:
а) периодический (циркуляционный) режим ( рис. 8а),
б) непрерывный (проточный) режим с частичной рециркуляцией ( рис. 8б),
в) непрерывный (прямоточный) режим ( рис. 8в).
В общем случае задачу можно сформулировать следующим образом ( рис. 8а–8в). Пусть имеем емкость Е1, содержащую раствор электролита с концентрацией C0k и объемом V0k, и пусть требуется сконцентрировать данный раствор с использованием баромембранного концентратора до концентрации Ckk. Во время концентрирования (или по окончании) концентрат собирается (или перекачивается) в емкость Е3, а пермеат накапливается в емкости Е2. Необходимо определить объем полученного концентрата Vkk и пермеата Vkp, конечную концентрацию пермеата Ckp в емкости Е2, продолжительность концентрирования tk и оценить производительность процесса баромембранного концентрирования. Найденные параметры позволят оценить эффективность той или иной технологической схемы.
Для упрощения оценочных расчетов сделаем несколько допущений:
1) вместо активностей электролита и воды будем оперировать концентрацией электролита,
2) общая рабочая площадь мембран S и рабочее давление Dp в баромембранном концентраторе одинаковы для всех рассматриваемых вариантов,
3) не будем учитывать явление концентрационной поляризации мембран и конструктивные особенности баромембранного концентратора, так как допустим, что скорость прокачки концентрируемого раствора над поверхностью мембран очень высока (случай, показанный на рис. 8в будет рассмотрен отдельно),
4) будем пренебрегать внутренним объемом трубопроводов и баромембранного концентратора ввиду их малости по сравнению с объемом концентрируемого раствора.
На основании проведенного экспериментального исследования примем, что селективность и удельная проницаемость тонкопористых мембран связаны с концентрацией раствора электролита в баромембранном концентраторе следующими соотношениями:
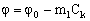 (6), (6),
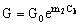 (7), (7),
здесь f 0 и G0 – селективность и удельная проницаемость мембраны при Ck®0, m1 и m2 – константы. При выводе соотношений (6–7) использованы графические зависимости (рис. 5, 6), которые не соответствуют уравнению (5), но значительно упрощают дальнейший анализ. Следует подчеркнуть, что все константы в соотношениях (6–7) зависят от рабочего давления и не являются константами при его изменении.
Периодический (циркуляционный) режим ( рис. 8а). Запишем уравнения, связывающие изменения объема концентрируемого раствора, Vk, и общего количества электролита в нем, CkVk, с объемным и солевым потоками через мембрану:
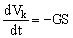 (8), (8),
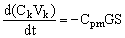 (9), (9),
здесь t – время, Cpm = Ck(1–f) – текущая концентрация электролита в пермеате (следует подчеркнуть, что она отличается от текущей концентрации электролита в емкости Е2).
Подставим выражение для GS из уравнения (8) в уравнение (9) и преобразуем его с учетом уравнения (6) к виду:
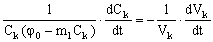 (10). (10).
Уравнение (10) нетрудно решить при начальном условии: Ck(t=0) = C0k и Vk(t=0) = V0k. Опустим тривиальный вывод и запишем сразу конечное решение для случая окончания процесса концентрирования, когда Ck = Ckk:
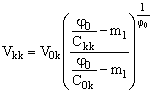 (11). (11).
Уравнению (11) можно придать более наглядный вид, если ввести коэффициент концентрирования электролита KC = Ckk/C0k и коэффициент сокращения объема KV = V0k/Vkk:
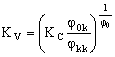 (12), (12),
здесь f 0k и fkk – начальная и конечная селективности мембраны.
Найти объем полученного пермеата, V kp, и конечную концентрацию пермеата, Ckp, в емкости Е2 можно из уравнений материального баланса по электролиту и объему:
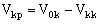 (13), (13),
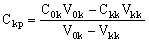 (14). (14).
Гораздо сложнее определить продолжительность концентрирования, tk. Нам не удалось получить аналитического решения этой задачи, поэтому для расчета времени концентрирования в данной работе использовали приближенные численные методы расчета.
Производительность баромембранного концентрирования, Qkk, предлагается, по аналогии с электроосмотическим концентрированием, определять по концентрату – целевому продукту данного процесса:
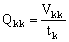 (15). (15).
Непрерывный (проточный) режим с частичной рециркуляцией ( рис. 8б). В данном случае вследствие квазистационарности процесса концентрирования искомые параметры найти проще, чем в циркуляционном режиме. Запишем уравнения материального баланса по объемному и солевому потокам:
 (16), (16),
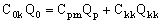 (17), (17),
здесь Q 0, Qp и Qkk – производительность баромембранного концентратора по исходному раствору, пермеату и концентрату, соответственно.
Будем считать концентрацию электролита в промежуточной емкости Е4 равной концентрации электролита в концентрате, C kk, так как ранее мы допустили, что скорость прокачки раствора через баромембранный аппарат очень высокая. В этом случае концентрация электролита в пермеате равна:
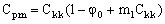 (18). (18).
Подставим в уравнение (17) значение Q p, найденное из уравнения (16), и значение Cpm, определяемое уравнением (18), и найдем из полученного выражения значение Qkk:
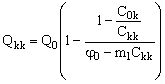 (19). (19).
Можно записать уравнение (19) в более наглядном виде, используя коэффициент концентрирования электролита, K C, и конечную селективность мембраны, j
kk:
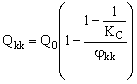 (20). (20).
Нетрудно заметить, что решение (19) имеет смысл только при положительной величине выражения в круглых скобках. Область дозволенных режимов работы предложенной технологической схемы можно определить из неравенства:
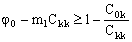 (21). (21).
Неравенство (21) приводит к важному выводу о том, что для проточного с частичной рециркуляцией режима работы баромембранного концентратора существует предельная величина коэффициента концентрирования электролита, которая связана с селективностью тонкопористой мембраны:
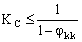 (22). (22).
Значение производительности баромембранного концентратора по исходному раствору, Q 0, можно найти из уравнения (16), если подставить в него значение Qkk из уравнения (19) и учесть, что Qp = GS.
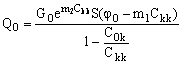 (23). (23).
При выводе уравнения (23) значение G определяли по уравнению (7).
Подставим значение Q0 из уравнения (23) в уравнение (19) и преобразуем его:
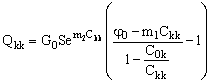 (24). (24).
Уравнение (24) полностью определяет производительность баромембранного концентратора, при условиях, которые определены неравенствами (21–22). Ограничения по концентрированию раствора электролита в баромембранном концентраторе в проточном с частичной рециркуляцией режиме принципиально отличают этот режим концентрирования от циркуляционного.
Непрерывный (прямоточный) режим ( рис. 8в). Прямоточный режим баромембранного концентрирования значительно упрощает технологическую схему установки, однако, в данном случае, допущение о высокой скорости прокачки концентрируемого раствора через мембранный аппарат становится неправомерным. Сформулируем систему допущений о режиме работы баромембранного концентратора следующим образом.
Будем рассматривать мембранный канал прямоугольного сечения с постоянной высотой , h, и шириной, b. Длина мембранного канала l = S/b. Для упрощения оценки будем пренебрегать концентрационной поляризацией поверхности мембраны в канале – это грубое допущение, так как скорость течения раствора над поверхностью мембраны в прямоточном баромембранном концентраторе не может быть очень высокой. Не будем учитывать продольную диффузию в мембранном канале, а также допустим, что пермеат, получаемый на различных участках мембранного канала, не перемешивается. Ближайший аналог такого мембранного канала – реактор идеального вытеснения (РИВ), который ранее был использован нами для описания массопереноса в идеальной обессоливающей камере электродиализатора [10].
Запишем уравнения, связывающие изменения расхода концентрируемого раствора, Qk, и общего количества электролита в нем, CkQk, с объемным и солевым потоками через мембрану:
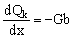 (25), (25),
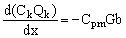 (26), (26),
здесь x – продольная координата в мембранном канале. Граничным условием для системы уравнений (25–26) будет являться: Ck(x=0) = C0k и Qk(x=0) = Q0k.
Обратим внимание на то, что вид уравнений (25–26) и характер граничных условий близок к уравнениям (8–9), поэтому решение можно получить таким же способом. Производительность баромембранного концентратора по концентрату будет равна:
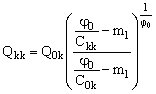 (27). (27).
Уравнение (12) будет справедливо и для прямоточного баромембранного концентратора.
Найти производительность баромембранного концентратора по пермеату, Qkp, и усредненную по длине мембранного канала концентрацию пермеата, Ckp, можно из уравнений материального баланса по электролиту и объему:
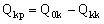 (28), (28),
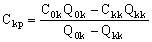 (29). (29).
Наиболее трудной задачей явилось определение значения производительности баромембранного концентратора по исходному раствору, Q0, которая, в свою очередь, является функцией высоты и длины мембранного канала. В данной работе для расчета Q0 были использованы приближенные численные методы расчета (в частности, метод прогонки), так как аналитическое решение этой задачи получить не удалось.
Результаты расчета ( рис. 9) однозначно показывают, что циркуляционный и прямоточный режимы работы баромембранного концентратора намного эффективнее проточного режима с частичной рециркуляцией концентрируемого раствора.
При расчете задали следующие значения параметров: C0k = 40 г/л; S = 1 м2; V0k = 1 м3; f0k = 0,59414; G0 = 1,9216 м3/м2·сут; m1 = 0,001589 л/г; m2 = –0,0056 л/г. Для прямоточного режима использовали характерное для рулонных мембранных элементов значение длины мембранного канала L = 1 м.
Следует заметить, что для прямоточного режима при характерной высоте мембранного канала 1 мм скорость течения раствора над поверхностью мембраны не превышает 2,8 см/с даже при низких коэффициентах концентрирования. Очевидно, что допущение об отсутствии концентрационной поляризации поверхности мембраны при такой скорости потока является некорректным. Вот почему для прямоточного режима концентрирования раствора электролита в баромембранном аппарате на практике следует ожидать значительно худших результатов.
В заключение подчеркнем, что данная проблема была изучена в связи с очисткой и концентрированием радиоактивных вод, так как стоимость захоронения радиоактивных отходов высока и доходит до 3000–5000 долларов США за 1 м 3 радиоактивных отходов. По требованиям СПОРО-85 [11] к жидким радиоактивным отходам, подаваемым на цементирование, их солесодержание не должно превышать 200 г/л. На битумирование можно подавать радиоактивные растворы с солесодержанием до 300 г/л. Очевидно, что условия проведения процесса очистки радиоактивных вод с использованием баромембранных аппаратов должны быть такими, чтобы солесодержание радиоактивных концентратов максимально приближалось к указанным выше значениям.
[ На Список литературы]
Copyright ©
|
|
 |
 |
Для того, чтобы мы могли качественно предоставить Вам информацию, мы используем cookies, которые сохраняются на Вашем компьютере (сведения о местоположении; ip-адрес; тип, язык, версия ОС и браузера; тип устройства и разрешение его экрана; источник, откуда пришел на сайт пользователь; какие страницы открывает и на какие кнопки нажимает пользователь; эта же информация используется для обработки статистических данных использования сайта посредством интернет-сервисов Google Analytics и Яндекс.Метрика). Нажимая кнопку «СОГЛАСЕН», Вы подтверждаете то, что Вы проинформированы об использовании cookies на нашем сайте. Отключить cookies Вы можете в настройках своего браузера.
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование
материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
|


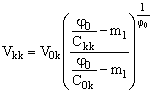 (11).
(11).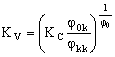 (12),
(12),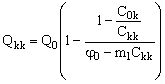 (19).
(19).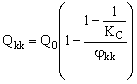 (20).
(20).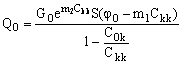 (23).
(23).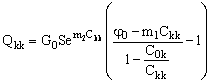 (24).
(24).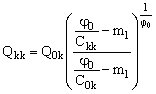 (27).
(27).