Точные сведения о расположении атомов и молекул в пространстве кристаллического вещества – одно из важнейших достижений естествознания XX в. Накопление этой информации стало возможно благодаря возникновению и развитию рентгеноструктурного анализа, основы которого заложили У. Г. и У.Л.Брэгги. На базе рентгеноструктурных данных сформировалась кристаллохимия, и первые же обобщения этой науки, датируемые 20-ми годами, были связаны с попытками интерпретировать межатомные расстояния с помощью эффективных атомных радиусов. Вскоре, однако, выяснилось, что такие расстояния существенно зависят от характера межатомных взаимодействий. Эти взаимодействия оказалось удобно подразделять на четыре основых типа: ковалентные, ионные и металлические связи, а также остаточные, или ван-дер-ваальсовы взаимодействия. Последние особенно ярко проявляются в межмолекулярных силах и во взаимодействии тех частей молекулы, атомы которых не связаны валентно, но достаточно сближены в пространстве. В их названии увековечено имя Я.Д.Ван-дер-Ваальса, который в 1873 г. предложил общеизвестное уравнение, учитывающее притяжение молекул в реальном газе (или жидкости); в 1910 г. за исследования в этой области ему была присуждена Нобелевская премия.
Впервые ван-дер-ваальсовы радиусы (ВР) атомов, входящих в состав молекул, независимо рассмотрели Мак (в работе, которая была получена редакцией 25 сентября 1931 г. и опубликована 6 июня 1932 г. [1]) и Магат (получено 10 декабря 1931 г., опубликовано в феврале 1932 г. [2]). В обеих работах имеются изображения молекул как совокупности перекрывающихся ван-дер-ваальсовых сфер. Мак сопоставляет понятие эффективного ВР с представлениями о распределении электронной плотности, снижающейся при удалении от ядра, и взаимной компенсации ван-дер-ваальсова притяжения и отталкивания, которое возрастает при сближении атомов. Он отчетливо показывает разницу между кристаллическими ВР, определяющими кратчайшее расстояние между атомами соседних молекул, и газокинетическими ВР, характеризующими максимальное сближение молекул при столкновении; в соответствии с их физическим смыслом первые возрастают, а вторые уменьшаются при повышении температуры. Впоследствии и те, и другие ВР нашли широкое применение: кристаллические ВР в кристаллохимии и структурной химии (при анализе конформации молекул и связанных с этим проблем), газокинетические ВР – в ряде разделов физической химии, причем в качестве газокинетических ВР нередко используются эффективные радиусы молекул, содержащих два или несколько атомов, в том числе молекул, имеющих цилиндрическую и более низкую симметрию, но тем не менее моделируемых сферами [3] .
В настоящей статье речь пойдет только об атомных кристаллических ВР, к которым чаще всего и относится термин "ван-дер-ваальсовы радиусы". При этом мы исключаем из рассмотрения ВР металлов, весьма условные по смыслу и чаще всего недостаточно корректно определенные, и имеем в виду ВР элементов-органогенов. В работе [4] мы описали область применения этих радиусов, по сути дела представляющую собой самостоятельную область знаний. Здесь мы ставим своей задачей дать исторический очерк развития аппарата ВР.
1. ИСТОРИЯ ТЕРМИНА "ВАН-ДЕР-ВААЛЬСОВ АТОМНЫЙ РАДИУС"
Этот термин утвердился в научной литературе после 1939 г., когда вышла в свет монография Полинга "Природа химической связи и структура молекул и кристаллов" [5]. Однако, как уже сказано, соответствующее понятие возникло раньше и фигурировало в статьях различных авторов под разными названиями. В пионерских работах (1932 г.) Мака [1] и Магата [2] речь идет соответственно о "кристаллическом радиусе" (crystal radius) и об "эффективном радиусе" (Wirkungsradius) связанных атомов. Стюарт в 1934 г. в статье "О новых моделях молекул" [6] вслед за Магатом пишет об "эффективных радиусах" и о "радиусах эффективных сфер связанных атомов". В том же году Орелкин и Лонсдейл [7] использовали выражение "ван-дер-ваальсовы сферы сил", что уже очень близко к "ван-дер-ваальсовым радиусам" Полинга.
В работах [1] и [7] имеются первые изображения плотной упаковки молекул, моделируемых внешней поверхностью пересекающихся атомных ван-дер-ваальсовых сфер; эти рисунки иллюстрируют невозможность взаимного проникновения сфер, относящихся к разным молекулам, и отсутствие значительных зазоров между соседними молекулами в кристалле, в чем и выражается основная сущность понятия ВР. Однако Мак [1] количественно охарактеризовал ВР водорода (1,29 A), оставив открытым вопрос о размерах атома углерода; в его работе бензольное кольцо моделируется как единое целое, ограниченное двумя сферами, центры которых лежат по обе стороны плоскости ароматического ядра (при этом используется "радиус купола" (dome radius), называемый также "радиусом области" (domain radius)). Орелкин и Лонсдейл [7], рассматривая кристаллическую структуру трифенилбензола, напротив, указывают лишь диаметр ван-дер-ваальсовой сферы атома углерода (3,7 А) .
Более детализированные изображения молекулярных упаковок появились в 1938-1939 гг. в работах Кори (дикетопиперазин [8]) и Альбрехта и Кори (глицин [9]); эти рисунки были воспроизведены в книге Полинга [5], благодаря чему приобрели широкую известность. Здесь в виде ван-дер-ваальсовых сфер изображены атомы кислорода, а также группировки CH 2, NH и NH 3 . Упаковки молекул, в которых все атомы моделируются в виде отдельных ван-дер-ваальсовых сфер, по-видимому, появились только в работах А.И.Китайгородского.
В 1946 г. Китайгородский в статье "Геометрический анализ расположения молекул в кристалле" [10], которая открыла цикл его работ 1946-1949 гг., впоследствии составивших основу монографии "Органическая кристаллохимия" [11], в качестве эквивалента ВР ввел термин "межмолекулярный радиус", определив его как "половину минимального расстояния между двумя атомами одного сорта (Н–Н, С–С и пр.)". В "Органической кристаллохимии" он пишет, что это сделано с целью указать источник оценки размеров сферы действия атома, и подчеркивает, что расстояния между валентно не связанными атомами одной и той же молекулы могут быть меньше, а иногда и существенно меньше суммы соответствующих межмолекулярных радиусов. В последующих работах Китайгородского, ставших классическими, фигурируют лишь "межмолекулярные радиусы", и все же этот термин не привился. В настоящее время в научной литературе принято говорить лишь о "ван-дер-ваальсовых радиусах".
2. ЭВОЛЮЦИЯ ПОНЯТИЯ "ВАН-ДЕР-ВААЛЬСОВ РАДИУС"
Чтобы проследить в основных чертах развитие представлений о ВР, нужно указать на некоторые важные особенности современного понимания физической сущности ВР. Только в этом случае будет ясно видна
историческая ретроспектива.
Прежде всего необходимо подчеркнуть, что ВР – это эффективная статистическая величина, а не физическая константа. Каждый конкретный межмолекулярный контакт подвержен влиянию упаковки молекул. Иными словами, ван-дер-ваальсовы сферы могут в некоторой степени "пружинить" так, чтобы энергия всей структуры оказалась минимальной. Поэтому в кристаллических упаковках могут иметь место небольшие перекрывания ван-дер-ваальсовых сфер или зазоры между ними. Отсюда следует, что из одной отдельно взятой кристаллической структуры в лучшем случае можно получить оценку того или иного ВР, но не его оптимальное значение. Наилучшие значения ВР, достаточно надежные и универсальные, находятся лишь путем статистической обработки распределений межмолекулярных контактов по расстояниям.
При этом во внимание должны приниматься только так называемые опорные, или структурообразующие, контакты (Китайгородский называл их определяющими). Выявление опорных контактов – это достаточно
тонкая процедура, базирующаяся на тщательном кристаллохимическом анализе рентгеноструктурных данных и проводимая по специальной методике .
Нужно также иметь в виду, что в кристаллах нередко встречаются специфические межмолекулярные атоматомные взаимодействия, содержащие значительный вклад электростатических или обменных сил. Контакты, длина которых может существенно отклоняться от обычных значений, нельзя использовать при определении стандартных величин ВР. Напротив, существенное отличие длины опорного контакта от стандартного значения часто является признаком его специфичности. Типичный пример специфического невалентного взаимодействия – водородная связь. Другие примеры, характерные для межмолекулярных взаимодействий в кристаллах, – контакты металл···кислород (во внутрикомплексных соединениях) [12], галоген···галоген [13,14] и др. Есть основания считать, что они имеют донорно-акцепторную природу [15]. Названные типы специфических контактов характеризуются повышенной (по абсолютной величине) энергией, они являются аттрактивными.
Наряду с этим в кратчайших атом-атомных невалентных контактах встречается и специфика иного рода. Внешняя поверхность некоторых молекул содержит столь значительное число ван-дер-ваальсовых сфер
электроотрицательных атомов, что в молекулярной упаковке неизбежно возникают опорные контакты между ними, несмотря на электростатическое отталкивание. Так, при наличии большого числа групп, содержащих кислород, нередко присутствуют непосредственные межмолекулярные контакты атомов кислорода. Однако последние несут на себе избыточные отрицательные заряды, и нетрудно предвидеть, что расстояния О···О будут завышены по сравнению с удвоенной величиной универсального ВР кислорода.
Таким образом, опорные контакты типа Cl···Cl, O···O и т.п., вообще говоря, нельзя использовать в качестве первоосновы для определения табличных значений ВР.
С другой стороны, разноименные контактирующие атомы часто несут на себе разноименные заряды, что способствует их сближению. Это можно учесть, принимая в качестве наиболее вероятной длины такого опорного контакта не сумму соответствующих ВР (R A + R B), а удвоенное среднее геометрическое ( 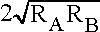 ) .
Еще одно обстоятельство, которое важно отметить, заключается в том, что аппарат ВР как универсальное средство анализа молекулярных упаковок применим лишь к достаточно крупным молекулам (включающим хотя бы 5-7 атомов). Малые молекулы – двух-, трех- и четырехатомные – в кристаллах часто имеют повышенные амплитуды тепловых движений, что сказывается на величинах эффективных ВР. Напротив, переход к макромолекулам не требует пересмотра таблицы ВР, поскольку благодаря достаточной гибкости сочленения мономеров каждый из них ведет себя как "средняя" по размерам молекула.
Первые попытки использовать систему универсальных ВР для описания межмолекулярных контактов и для моделирования молекулярного кристалла как упаковки тел, образованных внешней поверхностью перекрывающихся ван-дер-ваальсовых сфер [1, 2, 5 – 9], естественно основывались на весьма ограниченных (иногда единичных) кристаллических структурах. Правда, Полинг [5] использовал для построения таблицы ВР статистические данные по ионным радиусам (об этом сказано ниже); на отдельных кристаллических структурах органических веществ он проверял применимость такой методики.
Система ВР, подразумевавшая использование статистического подхода к анализу межмолекулярных расстояний в кристаллических веществах, была создана Китайгородским [11], который указывал, что межмолекулярные расстояния, соответствующие атом-атомному контакту данного типа (т.е. данной комбинации элементов), могут колебаться в пределах ±5% даже в одном кристалле. В числе факторов, обусловливающих непостоянство таких контактов, он называл различия в остаточных зарядах атомов, анизотропию колебаний молекул в кристаллах, а также различную ориентацию вектора, соединяющего центры соприкасающихся атомов разных молекул относительно направлений валентных связей атомов. Последнее отмечал и Полинг [5]; фактически здесь имеется в виду несферичность "ван-дер-ваальсова" атома в молекуле (мы еще вернемся к этому вопросу).
Разумеется, перечисленные обстоятельства требуют статистического усреднения значений ВР, полученных из различных структур, и, по-видимому, Китайгородский опирался на некоторую статистику. Однако эти статистические данные остались неявными, поскольку не были опубликованы. Впоследствии [16] Китайгородский предпочел находить табличные значения ВР из "эталонных" структур по отдельным "определяющим" контактам, что вряд ли можно расценивать как шаг вперед. В итоге в монографии "Молекулярные кристаллы" [16] появился набор ВР, явно ухудшенный по сравнению с величинами, которые были рекомендованы Китайгородским в "Органической кристаллохимии" [11].
Тенденция к получению статистически усредненного значения ВР присутствовала в работе Бонди [17]. Однако при этом был допущен целый ряд разного рода ошибок (см. ниже). Таким образом, и в этом случае нет оснований говорить о эволюции понятия ВР.
В 1972 г. была опубликована работа Зоркого и Зефирова "О молекулярном координационном числе" [18], в которой обнаружено, что многие кратчайшие межмолекулярные контакты значительно короче суммы ВР соответствующих атомов, особенно контакты с участием атомов кислорода (в качестве ВР здесь использовались радиусы Китайгородского [11], в том числе для кислорода 1,36 А). Это наблюдение послужило исходным пунктом для обстоятельных исследований по проверке и уточнению ВР, результатом чего явилась статья "Среднестатистические значения ван-дер-ваальсовых радиусов элементов-органогенов" [19].
Основой для создания статистической выборки служило определение понятия опорных структурообразующих контактов, существование которых необходимо и достаточно для обеспечения трехмерного каркаса касаний молекул в кристалле. При этом из множества межмолекулярных атом-атомных расстояний скрупулезно отбирались именно опорные контакты. Это исключало произвол и приводило к практически однозначному выделению нужных контактов в каждой кристаллической структуре. Далее структурообразующие контакты классифицировались по типам (С···Н, Н···Н, C···O и т.п.) и строились их распределения, которые обычно были достаточно близки к гауссовым, в итоге можно было найти наиболее вероятную длину контактов данного типа и ее дисперсию.
Примечательный результат работы [19] состоял в том, что наиболее вероятная длина опорного контакта разноименных атомов А и B оказалась ближе к величине 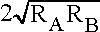 , чем к сумме R A + R B, что и было положено в основу уточнения табличных значений ВР и рекомендовано как оптимальная методика использования ВР при кристаллохимическом анализе. Как уже было сказано, эмпирическое правило 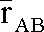 (опорное) » 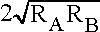 отражает небольшое перекрывание ван-дер-ваальсовых сфер в результате электростатического притяжения разноименно заряженных атомов.
В работе [19] были также опубликованы минимальные и максимальные длины зафиксированных опорных контактов. В рассмотренных структурах наибольшее отклонение длины структурообразующего контакта от среднего значения не превышает 0,3 А, а для контактов, не содержащих атомов водорода, – 0,15 А. Это наблюдение дало возможность обозначить границы между обычными ван-дер-ваальсовыми и специфическими взаимодействиями [20], в том числе водородными связями [21].
Мы уже говорили о том, что, начиная с Полинга [5] , неоднократно (в том числе в монографии [11]) отмечалась несферичность "ван-дер-ваальсова" атома, т.е. зависимость эффективного ВР от угла, который он образует с направлением ковалентной связи (например, связи С–Х в случае контакта C–X···Y). Такая зависимость действительно существует, особенно для контактов, в той или иное степени специфических [15,22] (более того, сам факт ее существования указывает на специфичность межмолекулярных контактов). Однако учет этого обстоятельства резко усложняет использование аппарата ВР, который хорош именно своей простотой и универсальностью. По нашему мнению, как правило, нет смысла вводить это усложнение. Лучше пользоваться усредненными по ориентациям значениями ВР, смирившись с приближенностью получаемых результатов, тем более что повышение точности этого аппарата потребовало бы учета и других факторов (например, валентного состояния атомов) .
Здесь, таким образом, намечается разумный предел эволюции понятия и аппарата ВР. Это исключительно удобное средство описания и интерпретации кристаллических структур и конформации сложных молекул, несомненно, позволяет получать лишь достаточно приближенные результаты. Тем не менее ВР широко употребляются и, конечно, еще долго будут употребляться для однозначного решения^ весьма многообразных задач [4]. С целью выявления и обсуждения более тонких структурных особенностей лучше обратиться к иным, более совершенным средствам (атомные орбитали, энергетические расчеты с использованием атом-атомных потенциалов или квантовохимических приближений и др.).
Примером неудачной попытки "усовершенствовать" ВР именно путем учета несферичности "ван-дер-ваальсова" атома может служить работа Найберга и Фаермана [23], которые упустили из виду, что только в опорных контактах величина ВР имеет ясный (хотя и эффективный, модельный) физический смысл и, следовательно, обоснованный выбор таких контактов составляет необходимый этап любого продвижения в этой области структурной химии.
3. ЧИСЛЕННЫЕ ЗНАЧЕНИЯ И СИСТЕМЫ ВАН-ДЕР-ВААЛЬСОВЫХ РАДИУСОВ
Строго говоря, первыми стали известны ВР инертных элементов (в 1924-1930 гг.), они легко определяются из кристаллических структур отвердевших инертных газов. Однако для анализа строения молекулярных кристаллов нужны ВР атомов, входящих в состав молекул; их определение представляет собой нетривиальную задачу.
Впервые такие значения ВР появились в работе Мака [1] , который, исходя из структур метана и этана при –195°C и гексаметилентетрамина при комнатной температуре нашел R H = 1,165 А (при –195°C) и 1,29 А (при комнатной температуре), R N = 1,5 А. Здесь обратим внимание на два обстоятельства.
Во-первых, рекомендуемые значения ВР весьма близки к тем, которыми пользуются сегодня (табл. 1). Во-вторых, уже в первой работе по определению ВР обнаруживается тенденция установить конкретную зависимость ВР от температуры. В действительности построить простую температурную зависимость ВР невозможно, поскольку в молекулярных кристаллах преобладают "внешние молекулярные колебания", т.е. колебания каждой молекулы как целого, и колебания отдельных относительно подвижных атомных группировок (фрагментов молекул) [24]; эти колебания зависят в первую очередь не от индивидуальности атомов, а от размеров и формы молекул и подвижных фрагментов. И все же ВР, хотя и неявно, зависят от температуры, и поэтому полезно помнить, что обычно используемые таблицы ВР относятся к температурам, близким к комнатной, поскольку в основном опираются на рентгеноструктурные данные, полученные при комнатной температуре.
Значения ВР, фигурирующие в работе Магата [2], приведены в табл. 1. Они, как и ВР Мака, в основном достаточно близки к величинам, предложенным впоследствии, что еще раз свидетельствует о дальновидности, обычно свойственной первооткрывателям. Магат определил и ВР галогенов (F 1,4, Cl 1,65, Br<1,78, I<1,89 А), но поскольку при этом он использовал данные о кристаллах простых веществ, а межмолекулярные взаимодействия в кристаллических хлоре, броме и иоде весьма далеки от чисто ван-дер-ваальсовых, ВР оказались сильно заниженными; правильно установлена только величина ВР фтора (см. табл. 2). Так при определении ВР галогенов была впервые совершена ошибка, многократно повторенная впоследствии.
Таблица l. Ван-дер-ваальсовы радиусы элементов-органогенов (А)
Элемент
|
Магат,
1932
[2]
|
Полинг,
1939
[5]
|
Китайгородский,
1955
[11]
|
Китайгородский,
1971
[16]
|
Бонди,
1964
[17]*1
|
Зефиров, Зоркий,
1974
[19]
|
|
C
|
1,63
|
1,85*2
|
1,72*3
|
1,80
|
1,70
|
1,71
|
|
H
|
1,26
|
1,2
|
1,17
|
1,17
|
1,20
|
1,16
|
|
O
|
1,36
|
1,40
|
1,36
|
1,52
|
1,52
|
1,29
|
|
N
|
1,51
|
1,5
|
1,57
|
1,58
|
1,55
|
1,50
|
|
Cl
|
1,65
|
1,80
|
1,78
|
–
|
1,75
|
1,90
|
|
S
|
–
|
1,85
|
2,02
|
–
|
1,80
|
1,84 [32]
|
*1 Приведены радиусы для атомов, образующих только ординарные связи (в случае водорода - для алифатических соединений).
*2 Приведена полутолщина ароматической молекулы (в третьем издании книги [5] Полинг заменил это значение на 1,70 А, оставив прочие значения неизменными).
*3 Приведено значение радиуса атома углерода в ароматических молекулах; алифатическому углероду придается радиус 1,80 А (в последующей работе [16] Китайгородский принял значение 1,80 А в качестве универсального).
Значения ВР, приведенные Стюартом [6] и использованные им для построения получивших огромную известность объемных моделей молекул, ближе к газокинетическим (они существенно меньше значений
кристаллических ВР). Поэтому модели Стюарта не пригодны для анализа упаковки молекул в кристаллах. Для этой цели оказался подходящим лишь вариант моделирования, осуществленный Кори и Альбрехтом [8,9], а затем Китайгородским [10,11].
Первая таблица ВР под современным названием "Ван-дер-ваальсовы радиусы атомов (в А)" появилась в 1939 г. в монографии Полинга [5]:
|
|
|
|
|
|
|
H
|
1,2
|
|
Радиус метильной
группы CH3 2,0 A.
Полутолщина ароматической
молекулы 1,85 A
|
|
N
|
1,5
|
|
O
|
1,40
|
|
F
|
1,35
|
|
|
P
|
1,9
|
|
S
|
1,85
|
|
Cl
|
1,80
|
|
|
As
|
2,0
|
|
Se
|
2,00
|
|
Br
|
1,95
|
|
|
Sb
|
2,2
|
|
Te
|
2,20
|
|
I
|
2,15
|
|
Возможность использования ионных радиусов в качестве ван-дер-ваальсовых Полинг обосновывает на примере хлора: "Ван-дер-ваальсов радиус хлора должен быть примерно равен его ионному радиусу, так как та сторона связанного атома, которая обращена наружу (в направлении, противоположном связи), имеет такой же вид, как и ион Cl во всех направлениях". Для подтверждения этого соображения Полинг сравнивает расстояния между атомами хлора разных молекул в кристалле 1,2,3,4,5,6-гексахлорциклогексана (3,60, 3,77, 3,82 А) с удвоенным ионным радиусом хлора 3,62 А.
Использование гораздо более обстоятельно изученных к тому времени ионных радиусов в качестве ВР существенно расширило круг известных значений ВР. Вместе с тем при обращении к элементам V группы
выявилась ограниченность такого подхода. В этом случае Полингу пришлось, сообразуясь с экспериментальными данными, уменьшить рекомендуемые значения ВР на 0,2 А (по сравнению с ионными радиусами). Для углерода он ограничился косвенными характеристиками ВР.
Таким образом, имевшихся в распоряжении Полинга к 1939 г. рентгеноструктурных данных хватило лишь на то, чтобы проверить справедливость предположения о примерном равенстве ВР и ионных радиусов и внести поправку в ВР элементов подгруппы азота. Последующее накопление результатов рентгеноструктурных исследований дало возможность Китайгородскому к 1955 г. создать систему ВР, полностью основанную на результатах анализа межмолекулярных расстояний в кристаллах. В монографии "Органическая кристаллохимия" [11] Китайгородский опубликовал величины "средних межмолекулярных радиусов" для семи элементов (H, C, N, O, Cl, Br, I) и, кроме того, дал значения ВР еще для двух элементов (S и Hg) при описании отдельных структур (см.
табл. 1) .
В отличие от своих предшественников Китайгородский стремился связать конкретные значения ВР с общими теоретическими представлениями – с теорией плотной упаковки молекул в органическом кристалле. Согласно этой концепции, каждая молекула в кристаллическом веществе должна образовывать опорные контакты, обеспечивающие ее стабильное равновесное расположение в пространстве. Однако конкретные правила отбора таких контактов не были сформулированы. При этом предполагалось, что предпочтительно определять значения ВР из контактов одноименных атомов. В итоге возникли некоторые неточности.
Так, в своих ранних исследованиях [10] Китайгородский нашел для ВР углерода значение 1,72 А. В монографии 1955 г. [11] он рекомендовал эту величину только для крупных ароматических молекул; для прочих случаев была предложена явно завышенная величина 1,80 А. По-видимому, причиной этого как раз и явилось стремление определять ВР из контактов С···С (при ограниченном объеме надежных экспериментальных данных).
Тем не менее значения ВР, приведенные в "Органической кристаллохимии" , в целом создали убедительную картину молекулярного кристалла, построенного по принципу плотной упаковки, и дали надежную основу для последующего статистического уточнения уже известных ВР и определения ВР для атомов других элементов.
Примечательным эпизодом в истории уточнения оптимальных значений ВР явилась в целом весьма неудачная, но, к сожалению, часто цитировавшаяся работа Бонди "Ван-дер-ваальсовы объемы и радиусы", опубликованная в 1964 г. [17]. она оказалась привлекательной для широкого круга ученых тем, что в отличие от книги Китайгородского [11] содержала столь же обширный список рекомендованных радиусов, как и таблица Полинга [5] (и даже превосходила его за счет включения в таблицу инертных элементов и кремния), и якобы была основана на новейших рентгеноструктурных и физико-химических данных.
О своем подходе сам Бонди писал так: "Межмолекулярные ван-дер-ваальсовы радиусы неметаллов собраны в таблицу "рекомендуемых" значений для расчетов объема. Эти значения получены при отборе из наиболее надежных рентгеновских данных, которые можно согласовать с плотностью кристалла при 0 К (чтобы получить разумную плотность упаковки), с газокинетическим сечением соударения, критической плотностью и свойствами жидкого состояния. Качественное понимание природы ван-дер-ваальсовых радиусов дается корреляцией с длиной волны де Бройля внешних валентных электронов". Как видно из приведенной цитаты, значения ВР Бонди получал, с одной стороны, из рентгеноструктурных данных, а с другой – из данных по газам, жидкостям и гипотетической плотности кристаллов при 0 K. При этом первые данные оказались в подчиненном положении: из них отбирались только те, которые "можно согласовать" со вторыми. В результате рентгеноструктурные сведения, которые не соответствовали данным, полученным из газов, жидкостей и гипотетической плотности кристаллов при 0 К, попросту игнорировались.
Оставляя без комментариев более чем сомнительное утверждение о корреляции ВР с "длиной волны де Бройля внешних валентных электронов", отметим, что Бонди явно не учел принципиального различия газокинетических и кристаллических ВР, четко зафиксированного еще в работе Мака [1]. Что же касается использования данных рентгеноструктурного анализа, то здесь Бонди допустил ряд очевидных ошибок. Например, при определении ВР кислорода он использовал расстояния O···O и C···O, не являющиеся опорными контактами. Проведенная нами проверка показала, что в рассмотренных им кристаллических структурах (хлоранил и др.) эти расстояния оказываются наибольшими сторонами треугольников
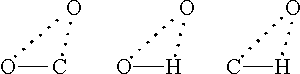
(пунктиром показаны межмолекулярные атом-атомные контакты); в роли опорных здесь выступают другие контакты (C···O и H···O), и лишь они могут быть использованы для оценки значений ВР. Так, в структуре хлоранила (тетрахлор-п-бензохинон) [25] в треугольнике OCO расстояние O···O равно 3,26 А, что якобы дает ВР кислорода 1,63 А, но касание молекул определяется контактом O···C длиной 2,85 А, и, если принять, как это делает Бонди, ВР углерода равным 1,70 А, получим для ВР кислорода величину 1,15 А. В других структурах Бонди использует для определения ВР кислорода расстояния O···O, соответствующие Н-связи, хотя сам указывает на недопустимость этого. В итоге он получил завышенное значение ВР кислорода (1,50 А), которое, по его мнению, соответствует плотности жидкого кислорода. Однако последнее, если это правильно, указывает лишь на то, что характеристики жидкого состояния нельзя непосредственно использовать для определения кристаллических ВР.
В таблице ВР, предложенной Бонди, не обошлось и без типичного занижения ВР галогенов, заимствованных из работы Сакмана [26] (ни Сакман, ни Бонди не учли специфичности контактов галоген···галоген, приводящей к их сокращению).
Таким образом, работа Бонди [17] выполнена небрежно и изобилует как систематическими, так и случайными (в том числе аряфметическими) ошибками. Она оказалась шагом назад по сравнения с предшествующим циклом исследований Китайгородского, обобщенных в "Органической кристаллохимии".
Однако и сам Китайгородский, к сожалении, не стал отстаивать свои первоначальные позиции. В монографии "Молекулярные кристаллы", опубликованной в 1971 г. [16], возобладал подход, базирующийся на определении каждого значения ВР не по ряду структур, а по одной "эталонной" структуре, причем исключительно по контактам одноименных атомов. В этой книге для определения ВР водорода Китайгородский использовал всего одну структуру адамантана, которую принял за эталонную, в то время как до 1955 г. адамантан был лишь одной из многих структур, взятых для этой цели. Для определения ВР углерода в качестве эталона взята структура графита, из которой получена величина 1,80 А. Аналогичная ситуация и с ВР азота, где в качестве эталона был избран триазид циануровой кислоты, откуда ВР азота найден равным 1,58 А. Для кислорода отправным пунктом послужила структура гексанитробензола, из которой следовало значение ВР 1,53 А. В итоге табличные значения ВР углерода, азота и кислорода были пересмотрены, причем во всех трех случаях ухудшены.
Примечательна аргументация, которая привела к существенному изменению рекомендуемого значения ВР кислорода. В этом случае ВР, полученный из гексанитробензола [27] (по касаниям типа О···О), сопоставлен со значениями, которые могли бы вытекать из других структур. В связи с этим указана структура пентакарбонила железа [28], у которого вся молекула окаймлена атомами кислорода и в упаковке осуществляются только касания типа О···О. Однако эта структура без объяснения причин эталонной не признается, хотя из нее могло бы следовать, что "средний межмолекулярный радиус кислорода равен 1,59 А" [16, с.83]. Далее рассмотрена структура аллоксана [29], относительно которого сказано: "касания в структуре осуществляются атомами О соседних молекул, находящимися .на расстояниях: 2,94, 3,05 и 3,07 А. Отсюда средняя величина R O = 1,51 А. Величина R O = 1,36 А, указанная в монографии автора [11] , оказывается заниженной".
Итак, Китайгородский признал свою "ошибку" и значительно увеличил ВР кислорода, хотя, как показывают статистические данные по кристаллическим структурам кислородсодержащих органических веществ [19], его, напротив, следовало бы уменьшить. Действительно, если требуется, чтобы ВР функционировали как универсальные трансферабельные аддитивные величины, описывающие опорные контакты не только одноименных, но и разноименных атомов, значение ВР кислорода 1,52, и даже 1,36 А, неприемлемо.
Об этом свидетельствуют, в частности, рассмотренный выше пример хлоранила (из работы Бонди), а также использованная Китайгородским структура аллоксана, ибо, как видно из приведенного в монографии [16] рисунка, в этой структуре опорными являются отнюдь не указанные им "контакты" О···O, а гораздо более короткие и относительно (по сравнению с суммой ВР) и абсолютно контакты C···O (2,79 А) и O···H (2,38 и 2,47 А), в которых, если считать, что ВР равен 1,52А, обнаружится совершенно невероятное перекрывание ван-дер-ваальсовых сфер (до 0,5 А). Здесь, стало быть, присутствует та же ошибка, что и в работе Бонди [17]. Если принять, согласно Китайгородскому [16], R C = 1,80 и R H=1,17 А, то из структуры аллоксана вытекает среднее значение R O=1,19 А.
И еще раз то же недоразумение встречается при обсуждении упаковки в структуре CO 2. О ней Китайгородский пишет: "Значение R O = 1,52 А находит подтверждение в недавних энергетических расчетах, проведенных для структуры CO 2 [30]" [16, с.25]. Между тем в этой структуре надо было бы учесть в первую очередь межмолекулярные контакты С···О длиной 3,07 А (при кратчайших расстояниях О···О длиной 3,14А) [31], что дало бы R O = 1,27 A.
Относительно структур, в которых межмолекулярные опорные контакты вынужденно осуществляются одноименными атомами, несущими значительный эффективный заряд (гексанитробензол, пентакарбонил железа и т.п.), выше было сказано, что следует ожидать появления расстояний, превышающих табличный ван-дер-ваальсов радиус; так оно и получается в действительности. Может быть, для таких структур имело бы смысл указывать специальные увеличенные значения ВР, полученные путем статистической обработки соответствующих данных (и такой ВР кислорода действительно оказался бы близким к 1,5 А). Однако по самой сущности этого понятия любой эффективный атомный радиус имеет смысл лишь как аддитивная или используемая иначе (например, в формуле типа r AB = 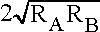 ), но обязательно более или менее универсальная величина, применимая к контактам разного типа. Поэтому естественно просто дополнить табличные сведения о ВР указанием наиболее вероятной длины опорных контактов типа О···O и ее дисперсии.
В 1974 г. статистически уточненные значения ВР пяти основных элементов-органогенов (табл. 1) были опубликованы в работе Зефирова и Зоркого [19], в которой для их определения использовано 406 опорных контактов из 75 кристаллических структур без водородных связей. Строго говоря, их следует применять в сочетании с комбинационным правилом r AB = 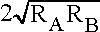 , однако, поскольку в диапазоне наблюдаемых величин ВР среднее арифметическое и среднее геометрическое не слишком значительно различаются, допустимы оценки, предполагающие простую аддитивность.
Примечательно, что Зефиров и Зоркий дали минимальное из всех встречающихся в литературе значение ВР кислорода. Последнее иногда вызывает сомнения (при рассмотрении контактов О···О), но такова реальность, наблюдаемая в контактах кислорода с атомами других элементов ; это подметил и Китайгородский в ранних работах [11), приняв тогда достаточно низкое значение этого ВР.
Несколько позже [32] был найден среднестатистический ВР серы, а затем в работах Зефирова и Порай-Кошица [33, 34] определены ВР галогенов (табл. 2).
Установление корректных значений ВР галогенов имеет важные особенности. ВР атома фтора был найден [33] путем анализа опорных контактов F···F в кристаллах соединений с общими формулами (MF 5) 4 и ЭF 6. В данном случае это оказалось возможным потому, что во взаимодействии таких молекул большой отрицательный заряд на атоме фтора компенсируется в 5 или 6 раз большим положительным зарядом на атомах М или Э.
Таблица 2. Ван-дер-ваальсовы радиусы галогенов (А)
|
Галоген
|
Полинг,
1939
[5]
|
Бонди,
1964
[17]
|
Зефиров,
1974 – 1986
[19, 33, 34]
|
Найберг,
1985
[23]
|
Китайгородский,
1955
[11]
|
|
F
|
1,35
|
1,47
|
1,40
|
1,30 – 1,38
|
—
|
|
Cl
|
1,80
|
1,75
|
1,90
|
1,58 – 1,78
|
1,78
|
|
Br
|
1,95
|
1,85
|
1,97
|
1,54 – 1,84
|
1,95
|
|
I
|
2,15
|
1,98
|
2,14
|
1,76 – 2,13
|
2,1
|
Относительно ВР прочих галогенов (хлор, бром, иод) важно отметить, что в работах [19, 34] они впервые были найдены с учетом возможности образования специфических контактов галоген···галоген, естественно, не пригодных для этой цели. Вместе с тем в исследовании [34] все же были использованы контакты атомов галогенов между собой, но с помощью анализа их угловых характеристик из рассматриваемого массива были исключены именно те расстояния, которые могли соответствовать специфическим взаимодействиям.
Мы уже упоминали о более поздней работе Найберга и Фаермана [23], также посвященной определению ВР галогенов. Здесь авторы учли существенное отклонение поля ван-дер-ваальсовых сил этих атомов от сферической симметрии (что косвенно отражает специфичность атом-атомных взаимодействий) , однако отсутствие четкой методики отбора опорных контактов, основанной на кристаллохимическом анализе, снижает ценность полученных результатов.
В заключение представляется полезным обсудить возможные перспективы дальнейшего расширения и уточнения численных значений ВР. Разумеется, имеет смысл провести еще один цикл приближения к оптимальным значениям ВР важнейших элементов-органогенов, опираясь на обширные статистические данные, которые появились в результате рентгеноструктурных исследований последних лет. Можно, однако, предвидеть, что это незначительно изменит величины, рекомендованные в работах [19, 33, 34]. Расширение круга химических элементов, фигурирующих в таблицах ВР, вряд ли может быть существенным, поскольку атомы прочих элементов, а также атомы металлов, как правило, экранированы ковалентно связанными с ними "соседями" или образуют специфические межмолекулярные контакты (вторичные связи).
В принципе возможна также попытка детализировать аппарат ВР, учитывая несферичность атомов или их Валентине состояния. По-видимому, таким образом удалось бы достичь более точной оценки наиболее вероятной длины невалентных контактов. Однако такое усовершенствование значительно уменьшает наглядность и универсальность используемой модели. Кроме того, приближенность исходных постулатов при этом стала бы более явной и неизбежно приводила бы во многих случаях к некорректным результатам. По нашему мнению, для уточненного описания и углубленной интерпретации геометрии ван-дер-ваальсовых контактов следует обратиться к физически более строгим подходам (атом-атомные или иные эмпирические потенциалы, квантовохимические методы). Однако это не обесценит простую и чрезвычайно эффективную модель ВР, незаменимую для быстрых качественных и полуколичественных оценок. Сказанное дает основание считать разработку этой модели в основном законченной.
Особый интерес представляет история применения аппарата ВР. В значительной мере она нашла отражение в обзоре [4]. Здесь мы выделим лишь некоторые основные вехи этой истории.
Важнейшие области применения ВР следующие: 1) кристаллохимия, 2) стереохимия, 3) рентгеноструктурный анализ, 4) физико-химические свойства веществ, 5) химические реакции.
В 30-е годы в работах [7-9] появились первые изображения молекулярных упаковок в кристаллах, а в 40- и 50-х годах на базе представлений о ВР Китайгородским [10, 11] была создана теория плотной упаковки молекул в кристаллах. Это явилось первым крупным обобщением органической кристаллохимии. Уточненные формулировки основных
постулатов теории плотных молекулярных упаковок были даны в работе [35]. Китайгородский нередко отмечал, что метод атом-атомных потенциалов [36], базирующийся на представлениях о неспецифических межмолекулярных контактах и составивший сущность следующего этапа органической кристаллохимии [35, 37], вытекал из концепции плотной упаковки, т.е. из ВР. Вместе с тем ВР позволили отчетливо выявить и систематически рассмотреть сокращенные специфические межмолекулярные контакты [12-15, 20, 22], что в конечном счете ведет к созданию новой обобщенной модели строения молекулярного кристалла. Таким образом, и этот (современный) этап развития органической кристаллохимии фактически предопределен идеей, заложенной в аппарате ВР.
Роль ВР в стереохимии молекул заключалась в том, что они давали надежное средство выявления стерических напряжений. На этой базе возник первый вариант конформационного анализа. Для его реализации были созданы модели Стюарта-Бриглеба [6, 38], которые и поныне широко используются химиками. Правда, в этих моделях использованы ВР, скорее более близкие к газокинетическим, чем к кристаллическим, но качественный результат, полученный с помощью такой модели, можно уточнить, используя более подходящие для этой задачи кристаллические ВР. В итоге появляется возможность априорного определения реальности или нереальности осуществления некоторых синтезов, широко используемая химиками-синтетиками.
Другой аспект использования ВР в стереохимии состоит в установлении запретов, налагаемых стерическими факторами на те или иные конформации. В этом плане особенно примечательны результаты, полученные в 50-х годах при установлении строения a-спирали полипептидов [39] и двойной спирали ДНК [40], которые признаны крупнейшими открытиями XX в. в начале 80-х годов исследования ДНК с использованием аппарата ВР были продолжены [41] для решения структурно- биологических задач, связанных с образованием неправильных пар оснований в этих структурах. Использование среднестатистических значений ВР и учет дисперсии ван-дер-ваальсовых контактов позволили показать возможность встраивания в двойную спираль нуклеиновых кислот неправильных пар оснований в обычных таутомерных формах без возникновения сокращенных межатомных контактов и существенного искажения сахарофосфатного остова.
Если использование ВР в кристаллохимии и стереохимии можно отнести к сфере фундаментальной науки (впрочем, часто дающей важные практические результаты) , то другие применения ВР, перечисленные выше, имеют прикладной характер, т.е., не затрагивая теоретических основ соответствующей области, они используются для получения конкретных сведений. Таким является применение ВР в рентгеноструктурном анализе (в тех случаях, когда экспериментальный метод сам по себе дает неоднозначный результат). Примеры такого рода можно найти в обзоре [4] .
Приложение ВР к обсуждению и прогнозу физико-химических свойств оказалось особенно успешным в следующих направлениях: 1) плотность кристаллов, коэффициент плотности упаковки и другие свойства, определяемые эффективным объемом, размерами и формой молекул, 2) вращение атомных группировок в кристаллах, 3) характеристики органических проводников. Обширный список литературы по этим приложениям дан в обзоре [4] .
Здесь отметим лишь, что применительно к прогнозу плотности веществ существенные преимущества дает построенная с помощью ВР система инкрементов молекулярных объемов. Последние, в частности, очень удобны для вычислений объемов молекул полимеров с постоянно повторяющимся звеном (или звеньями). С использованием объемных инкрементов в работах Аскадского и сотр. [42-44] были вычислены не только плотности, но и многие другие свойства полимеров (коэффициенты объемного расширения, температуры стеклования, температуры начала интенсивной термической деструкции, температуры плавления, показатели преломления, коэффициенты оптической чувствительности по напряжению, объемные модули упругости и др.) Существенно, что все эти характеристики могут быть рассчитаны еще до синтеза полимеров, исходя только из химического строения повторяющегося звена.
В отношении использования ВР при изучении влияния стерических факторов на ход химических реакций отметим, что в многочисленных работах такого рода (например, [4]) удалось интерпретировать эффекты различных типов: 1) пространственные затруднения, приводящие к растяжению ковалентных связей или к искажению валентных углов, 2) экранирование или полную блокировку активного центра молекулы, 3) стерические факторы, определяющие угол нуклеофильной или электрофильной атаки, и другие варианты влияния стерических эффектов на химические процессы.
Анализ многообразных приложений ВР показывает, что, если история создания аппарата ВР, по-видимому, в основном уже завершена, то история применения этого аппарата переживает свой кульминационный период и, скорее всего, принесет еще немало ценных результатов.
Московский государственный университет им. М.В.Ломоносова
ЛИТЕРАТУРА
- Mack Е. J. Amer. Chem. Soc. 1932. V.54. P.2141-2165.
- Magat М. Ztschr. phys. Chem. В. 1932. Bd.16. S.1-18.
- Гиршфельдер Дж., Кертисс Ч., Берг Р. Молекулярная теория газов и жидкостей / Пер. с англ. под ред. Е.В.Ступоченко. М.: Изд-во иностр. лит., 1961, 930 с.
- Зефиров Ю.В., Зоркий П.М. Успехи химии. 1989. Т.58, вып. 5. С.713-746.
- Pauling L. The nature of the chemical bond and the structure of molecules and crystals. L.: Cornell Univ. press, 1939. 429 p.; 3rd ed., 1960. 644 p. Рус. пер.: Паулинг Л. Природа химической связи / Пер. с англ. под ред. Я.К.Сыркина. М.: Госхимиздат, 1947. 440 с.
- Stuart H.A. Ztschr. phys. Chem. B. 1934. Bd.27. S. 350-358.
- Orelkin В., Lonsdale К. Proc. Roy. Soc. London A. 1934. Vol.144. P.630-642.
- Corey R.B. J.Amer. Chem. Soc. 1938. Vol.60, No 7. P.1598-1604.
- Albrecht G., Corey R.B. Ibid. 1939. Vol.61, No 5. P.1087-1103.
- Китайгородский А.И. Изв. АН СССР. ОХН. 1946, No 6. С.587-600.
- Китайгородский А.И. Органическая кристаллохимия. М.: Изд-во АН СССР, 1955. 588 с.
- Тищенко Г.Н., Зоркий П.М., Порай-Кошиц М.А. Журн. структур. химии. 1961. Т.2, No 4. С.434-444.
- Бельский В.К., Четкина Л.А., Зоркий П.М., Гольдер Г.А. Кристаллография. 1970. Т.15, No 3. С.262-267.
- Зефиров Ю.В. Журн. структур. химии. 1981. Т.22, No 2. С.194-196.
- Масунов А.Э., Зоркий П.М. Там же. 1992. Т.33, No 3. С.105-118.
- Китайгородский А.И. Молекулярные кристаллы. М.: Наука, 1971. 424 с.
- Bondi A. J. Phys. Chem. 1964. Vol.68, No 3. P.441-451.
- Зоркий П.М., Зефиров Ю.В. Вестн. МГУ. Сер. 2, Химия. 1972. Т.13, No 5. С.590-593.
- Зефиров Ю.В., Зоркий П.М. Журн. структур. химии. 1974. Т.15, No1. С.118-122.
- Зефиров Ю.В., Зоркий П.М. Там же. 1976. Т.17, No 6. С.994-998.
- Зефиров Ю.В. Журн. общ. химии. 1976. Т.46, No 11. С.2636-2640.
- Масунов А.Э., Зоркий П.М. Журн. физ. химии. 1992. Т.66, No 1. С. 60-69.
- Nyburg S.C., Faerman C.H. Acta crystallogr. B. 1985. Vol. 41, No 3. P.274-279.
- Афонина Н.Н., Зоркий П.М. Итоги науки и техники. Кристаллохимия. М.: ВИНИТИ, 1974. Т.10. С.149-198.
- Chu S., Geffrey G.A., Sakurai T. Acta crystallogr. 1962. Vol.15, No 7. P.661-671.
- Sackmann H. Ztschr. phys. Chem. 1958. Bd.208, No 3/4. S.235-248.
- Акопян З.А. Стручков Ю.Т., Дашевский В.Г. Журн. структур. химии. 1966. Т.7, No 3. С.408-416.
- Donohue J., Caron A. Acta crystallogr. 1964. Vol.17, No 6. P.663-667.
- Bolton W. Ibid. No 2. P.147-152.
- Китайгородский А.И., Мирская К.В., Научитель В.В. Кристаллография. 1969. Т. 14, No 5. С. 900-901.
- Plyler E.K. et al. J. Res. Nat. Bur. Stand. 1955. Vol.55. P. 183.
- Зефиров Ю.В., Зоркий П.М. Журн. структур. химии. 1976. Т.17, No 4. С.745-746.
- Зефиров Ю.В., Порай-Кошиц М.А. Там же. 1980. Т.21, No 4. С. 150-155.
- Зефиров Ю.В., Порай-Кошиц М.А. Там же. 1986. Т. 27, No 2. С. 74-81.
- Зоркий П.М. // Физическая химия: Современные проблемы. М.: ХИМИЯ, 1982. С.134-179.
- Китайгородский А.И.. Мирская К.В. Кристаллография. 1961. Т.6, No 4. С.507-514.
- Тимофеева Т.В., Черникова Н.Ю., Зоркий П.М. Успехи химии. 1980. Т.49, вып.6. С.966-997.
- Briegleb G. Fortschr. chem. Forsch. 1950. Bd.1. S.642-684.
- Pauling L., Corey.R.B. Proc. Nat. Acad. Sci. US. 1951. Vol.37. P.235; Proc. Roy. Soc. London B. 1953. Vol.141. P. 21-33.
- Watson J.D., Crick F.H.C. Nature. 1953. Vol.171. P.737-738.
- Chuprina V.P., Poltev V.I. Nucl. Acids Res. 1983. Vol.11. P. 5205.
- Аскадский A.A. // Успехи химии. 1977. Т.46, вып.6. С.1122-1151.
- Аскадский А.А., Матвеев Ю.И. Химическое строение и физические свойства полимеров. М.: Химия, 1983. 248 с.
- Аскадский А.А., Гальперин Е.Г., Матвеева Т.П. и др. Высокомолекуляр. соединения. А. 1987. т.29, No 11. С.2433-2440.
|


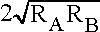 ) .
) .
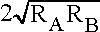 , чем к сумме RA + RB, что и было положено в основу уточнения табличных значений ВР и рекомендовано как оптимальная методика использования ВР при кристаллохимическом анализе. Как уже было сказано, эмпирическое правило
, чем к сумме RA + RB, что и было положено в основу уточнения табличных значений ВР и рекомендовано как оптимальная методика использования ВР при кристаллохимическом анализе. Как уже было сказано, эмпирическое правило 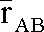 (опорное) »
(опорное) » 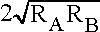 отражает небольшое перекрывание ван-дер-ваальсовых сфер в результате электростатического притяжения разноименно заряженных атомов.
отражает небольшое перекрывание ван-дер-ваальсовых сфер в результате электростатического притяжения разноименно заряженных атомов.