Учебное пособие содержит все традиционные разделы курса электрохимии.
В нем приведены примеры использования количественных соотношений
электрохимической термодинамики и кинетики для описания и прогнозирования
свойств реальных систем, основы научного подхода к решению задач, связанных
с практическим применением электрохимических систем. Рассмотрены
последние достижения в области разработки новых материалов для
электрохимических систем, современное состояние физических представлений
об элементарных явлениях в электрохимических процессах, физические методы
исследования растворов, межфазных границ и электродных материалов.
Для студентов, обучающихся по направлениям «Химия», «Химия, физика
и механика материалов», «Химические технологии», «Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии »,
«Фундаментальная и прикладная химия», «Химическая технология энергонасыщенных материалов и изделий », « Химическая технология материалов современной энергетики».
Оглавление
ОТ АВТОРОВ
|
|
8 |
| ВВЕДЕНИЕ |
|
11 |
| ТЕОРИЯ ЭЛЕКТРОЛИТОВ |
|
|
ГЛАВА 1. РАЗВИТИЕ ПРЕДСТАВЛЕНИЙ
ОБ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
|
| 16 |
| 1.1. Классические методы исследования растворов
электролитов |
| 16 |
| 1.2. Основные положения теории Аррениуса |
| 20 |
| 1.3. Ионные равновесия в растворах электролитов |
| 22 |
| 1.4. Недостатки классической теории
электролитической диссоциации |
| 25 |
| 1.5. Спектроскопические методы исследования
строения растворов электролитов |
| 27 |
ГЛАВА 2. ИОН-ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ
В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
|
| 38 |
| 2.1. Механизмы образования растворов электролитов |
| 38 |
| 2.2. Энергия кристаллической решетки |
| 39 |
| 2.3. Энергия сольватации |
| 42 |
| 2.4. Реальная и химическая энергии сольватации |
| 46 |
| 2.5. Энтропия сольватации ионов |
| 50 |
| 2.6. Корреляционные подходы к сравнению свойств растворителей |
| 51 |
| 2.7. Физические свойства полярных растворителей |
| 55 |
| 2.8. Состояние ионов в растворах |
| 65 |
| ГЛАВА 3. ИОН-ИОННОЕ ВЗАИМОДЕЙСТВИЕ
В РАСТВОРАХ ЭЛЕКТРОЛИТОВ |
| 71 |
| 3.1. Термодинамическое описание равновесий
в растворах электролитов |
| 71 |
| 3.2. Распределение ионов в растворе электролита и потенциал ионной атмосферы |
| 78 |
| 3.3. Теория Дебая — Хюккеля
и коэффициенты активности |
| 83 |
| 3.4. Применение теории Дебая — Хюккеля
к слабым электролитам и смешанным растворам электролитов |
| 92 |
| 3.5. Растворимость и теория Дебая — Хюккеля |
|
95 |
| 3.6. Ионная ассоциация в растворах электролитов |
| 96 |
| 3.7. Эмпирические и полуэмпирические методы
описания термодинамических свойств растворов |
| 101 |
| 3.8. Современное состояние и перспективы развития теории растворов электролитов |
| 105 |
| 3.9. Растворы полиэлектролитов |
| 113 |
| ГЛАВА 4. НЕРАВНОВЕСНЫЕ ЯВЛЕНИЯ
В РАСТВОРАХ ЭЛЕКТРОЛИТОВ |
|
118 |
| 4.1. Общая характеристика неравновесных явлений
в растворах электролитов |
| 118 |
| 4.2. Диффузия и миграция ионов |
| 120 |
| 4.3. Удельная и эквивалентная электропроводности
в растворах электролитов |
| 124 |
| 4.4. Числа переноса и методы их определения |
| 128 |
| 4.5. Предельные электропроводности ионов |
| 134 |
| 4.6. Зависимость подвижности, электропроводности
и чисел переноса от концентрации |
| 139 |
| 4.7. Особые случаи электропроводности
растворов электролитов |
|
147 |
| 4.8. Влияние вязкости среды на транспортные
явления в растворах |
| 156 |
| 4.9. Некоторые закономерности гомогенных реакций
в полярных средах и растворах электролитов |
| 160 |
| ГЛАВА 5. РАСПЛАВЫ И ТВЕРДЫЕ ЭЛЕКТРОЛИТЫ |
| 175 |
| 5.1. Строение ионных жидкостей
и их электропроводность |
| 175 |
| 5.2. Многокомпонентные расплавы |
|
187 |
| 5.3. Свойства твердых электролитов |
| 192 |
| 5.4. Подходы к теоретическому описанию процессов переноса в ионных твердых электролитах |
| 208 |
| 5.5. Твердые электролиты — аналоги жидких
растворов |
| 210 |
| 5.6. Электродные материалы со смешанной
проводимостью |
| 219 |
| ЭЛЕКТРОХИМИЯ ГЕТЕРОГЕННЫХ СИСТЕМ |
|
|
| ГЛАВА 6. ОСНОВЫ ТЕРМОДИНАМИКИ
ГЕТЕРОГЕННЫХ ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМ |
| 223 |
| 6.1. Электрохимический потенциал и равновесие
на границе электрод/растворя |
| 223 |
| 6.2. Равновесие в электрохимической цепи |
| 228 |
| 6.3. Окислительно-восстановительные полуреакции и понятие электродного потенциала |
|
240 |
| 6.4. Классификация электродов |
| 248 |
| 6.5. Концепция электронного равновесия
на границе металл/раствор |
| 253 |
| 6.6. Классификация электрохимических цепей |
| 259 |
| 6.7. Метод ЭДС при определении коэффициентов
активности, чисел переноса, произведений
растворимости и констант равновесия
ионных реакций |
| 268 |
| 6.8. Мембранное равновесие и мембранный потенциал |
| 275 |
| 6.9. Ионоселективные электроды |
|
277 |
| 6.10. Электрохимические биосенсоры
и биологические мембраны |
| 286 |
| 6.11. Биоэлектрохимия |
| 290 |
| 6.12. Равновесия на границе двух несмешивающихся
жидкостей |
| 295 |
| ГЛАВА 7. ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
И ЯВЛЕНИЯ АДСОРБЦИИ НА МЕЖФАЗНЫХ ГРАНИЦАХ |
| 298 |
| 7.1. Связь электрических и адсорбционных явлений на границе раздела фаз |
| 298 |
| 7.2. Адсорбционный метод изучения двойного
электрического слоя |
| 304 |
| 7.3. Электрокапиллярные явления |
| 308 |
| 7.4. Емкость двойного электрического слоя |
| 317 |
| 7.5. Вольтамперометрические и кулонометрические
методы изучения строения двойного электрического слоя и адсорбции на электродах |
| 324 |
| 7.6. Электрокапиллярные явления на совершенно
поляризуемом электроде |
| 331 |
| 7.7. Оптические и фотоэмиссионные методы
изучения двойного электрического слоя |
| 335 |
| 7.8. Зондовые методы исследования
электрохимических межфазных границ |
| 343 |
| 7.9. Вакуумно-электрохимические системы
и рентгеновские методы исследования
электрохимических межфазных границ |
| 349 |
| 7.10. Потенциалы нулевого заряда и механизм
возникновения ЭДС электрохимической цепи |
| 351 |
| 7.11. Развитие модельных представлений
о строении двойного электрического слоя |
| 360 |
| 7.12. Современные модельные представления
о двойном электрическом слое в растворах
поверхностно-неактивных электролитов |
| 364 |
| 7.13. Модельные представления
о двойном электрическом слое
при специфической адсорбции ионов |
| 374 |
| 7.14. Теория двойного слоя Фрумкина — Дамаскина
при адсорбции органических соединений |
| 388 |
| 7.15. Некоторые особенности строения двойного слоя на границах раздела металл/расплав
и полупроводник/раствор |
| 401 |
| ГЛАВА 8. ЭЛЕКТРОХИМИЧЕСКАЯ КИНЕТИКА.
СТАДИЯ МАССОПЕРЕНОСА |
| 411 |
| 8.1. Общая характеристика электрохимических
процессов |
| 411 |
| 8.2. Поляризационная характеристика в условиях
лимитирующей стадии массопереноса |
| 416 |
| 8.3. Роль миграции в процессах
массопереноса и падение потенциала
в диффузионном слое |
| 422 |
| 8.4. Конвективная диффузия и метод вращающегося
дискового электрода |
| 429 |
| 8.5. Полярографический метод |
| 433 |
| 8.6. Нестационарная диффузия при изменяющемся
во времени потенциале электрода |
| 438 |
| 8.7. Хронопотенциометрия |
| 448 |
| 8.8. Тонкослойные электрохимические ячейки
и ультрамикроэлектроды |
| 451 |
| 8.9. Константа скорости стадии массопереноса |
| 460 |
| 8.10. Массоперенос в пористых
электрохимических системах |
| 464 |
| ГЛАВА 9. ЭЛЕКТРОХИМИЧЕСКАЯ КИНЕТИКА.
КИНЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ
СТАДИИ ПЕРЕНОСА ЗАРЯДА |
| 471 |
| 9.1. Основные уравнения теории замедленного разряда |
| 471 |
| 9.2. Поляризационные кривые и импеданс
стадии переноса заряда |
| 483 |
| 9.3. Электрохимические реакции с последовательным
переносом нескольких электронов |
| 491 |
| 9.4. Методы изучения стадии переноса заряда
в условиях смешанной кинетики |
| 499 |
| 9.5. Зависимость скорости реакции переноса
электрона от температуры |
| 511 |
| 9.6. Влияние строения межфазной границы
и природы металла на кинетику выделения
водорода и электровосстановления анионов |
| 517 |
| 9.7. Теоретические представления об элементарном
акте гомогенного и гетерогенного
переноса электрона в полярных средах |
| 532 |
| 9.8. Безактивационный разряд |
| 559 |
| 9.9. Некоторые особенности стадии переноса
электрона на границе полупроводник/раствор |
| 566 |
| ГЛАВА 10. КИНЕТИКА СЛОЖНЫХ
ЭЛЕКТРОХИМИЧЕСКИХ РЕАКЦИЙ |
| 572 |
| 10.1. Электрохимические процессы в условиях
медленной гетерогенной химической реакции |
| 575 |
| 10.2. Электрохимические процессы в условиях
медленной гомогенной химической реакции |
| 580 |
| 10.3. Изучение многостадийных электрохимических
реакций путем нахождения их порядков
по различным компонентам раствора |
| 588 |
| 10.4. Электровосстановление кислорода и катодное
выделение водорода |
| 593 |
| 10.5. Коррозия металлов и методы защиты |
| 603 |
| 10.6. Электродные реакции, осложненные
образованием новой фазы |
| 612 |
| 10.7. Сложные электродные процессы и прикладная
электрохимия. Электродные материалы |
| 625 |
| ЗАКЛЮЧЕНИЕ |
| 656 |
| ЛИТЕРАТУРА |
| 659 |
| ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ |
| 666 |
Светлой памяти
Александра Наумовича
Фрумкина посвящаем
ОТ АВТОРОВ
В настоящей книге изложены основы электрохимической науки, фундамент которой составляют теория электролитов, электрохимическая термодинамика и кинетика. Учебник написан в соответствии с программами раздела электрохимии в общем курсе
физической химии для университетов и спецкурсов по двойному
слою и электрохимической кинетике на базе лекций, которые читаются на химическом факультете Московского государственного университета им. М.В.Ломоносова.
При создании учебника по целому ряду причин мы не могли
пойти по пути простого объединения двух ранее изданных пособий Б. Б. Дамаскина и О.А.Петрия (Введение в электрохимическую кинетику. М.: Высшая школа, 1983; Электрохимия. М.:
Высшая школа, 1987). Дело в том, что развитие электрохимии за
последние двадцать лет привело к возникновению ряда совершенно новых теоретических и прикладных направлений, а также новых концепций, относящихся к структуре электрохимических межфазных границ и закономерностям туннелирования
заряженных частиц. Этому немало способствовало использование современных физических подходов и экспериментальных
(например, зондовых микроскопических) методов, а также мощных методов моделирования явлений и процессов, протекающих
в конденсированных ионных системах и на границах раздела
фаз. В результате на рубеже тысячелетий удалось перейти к изучению процессов в фемтосекундных диапазонах и на атомном
уровне и выйти на следующий этап понимания сложных электрохимических явлений.
Новые направления исследований, имеющие большое теоретическое и прикладное значение, сравнительно быстро выкристаллизовались и обрели черты фундаментальности. В этом плане
можно отметить: строение и свойства растворов полиэлектролитов
и твердых полимерных электролитов; электрохимические свойства расплавов и твердых солей, особенно со сверхвысокой проводимостью (так называемых супериоников); выявление роли донорно-акцепторных взаимодействий при сольватации ионов (особенно
из-за перехода от традиционных водных растворов к апротонным
средам); микроскопическое описание явлений сольватации; физически обоснованную теорию элементарного акта ионных и электрохимических реакций; установление детальных механизмов
многостадийных электрокаталитических процессов; фотоэлектрохимическое преобразование солнечной энергии с использованием
полупроводниковых электродов; развитие оптических, зондовых
и рентгеновских методов исследования границы электрод/раствор
и кинетики электродных процессов; исследования в области электрохимической энергетики, электрохимической сенсорики и ряд
других. Вместе с тем нам кажется целесообразным показать в
учебнике тенденции развития теоретической электрохимии, возможности различных электрохимических методов, подчеркнуть
роль электрохимии в создании принципиально новых видов технологий (в том числе нанотехнологии) и новых источников электрической энергии, в борьбе с коррозией, в медицинской химии, в
получении сверхчистых материалов и материалов функционального назначения.
Электрохимия не только широко использовала и использует
достижения других областей знания, но и, как показывают многие примеры, сама щедро подпитывает различные области физики, химии и биологии новыми фактами и идеями. Более того, рожденные в недрах электрохимии отдельные направления
оформились с годами в самостоятельные междисциплинарные
разделы науки. Как говорил А. Н.Фрумкин, «...электрохимия —
это наука, которая в известном смысле сама себя "обкорнала".
В изложение курса электрохимии обычно включается меньший
объем материала, чем следовало бы включать». В этой книге мы
старались в какой-то степени устранить этот недостаток и отразить то представление об электрохимии, путях ее развития, проблемах и практических применениях, которое развивалось и поддерживалось А. Н. Фрумкиным.
В книге главное внимание обращено на изложение основ теоретической электрохимии, ее фундаментальных понятий и представлений с использованием подходов, которые нам кажутся
наиболее методически оправданными и в то же время достаточно
строгими. Так, механизм установления электродного потенциала
обсуждается детально на основе концепции электронного равновесия на границе металл/раствор. Приводятся примеры, показывающие возможность вычисления абсолютных скачков потенциала с использованием модельных представлений, что должно
способствовать более глубокому пониманию трудной проблемы
абсолютного потенциала. Обсуждение основного уравнения теории замедленного разряда проведено последовательно не только
на базе теории абсолютных скоростей реакций, но и в рамках современной квантово-механической теории элементарного акта
переноса заряда.
При изложении материала нами использована международная система единиц (СИ), а также в основном обозначения и терминология, предложенные Комиссией по электрохимии Международного союза по чистой и прикладной химии (IUРАС). Однако
мы сочли целесообразным сохранить термин «эквивалентная
электропроводность» (отмененный IUРАС), обозначение i для
плотности тока (вместо j) и знак «+» для катодного тока (вместо
«-»), которые укоренились в отечественной электрохимической
литературе.
Выражаем искреннюю признательность многим коллегам,
высказавшим свои замечания и пожелания к учебным пособиям
«Электрохимия» и «Введение в электрохимическую кинетику»
(см. выше), которые мы в основном учли в этом учебнике. Мы
особенно благодарны чл.-корр. РАН Ю.М. Полукарову за подробное обсуждение некоторых глав рукописи.
Когда работа над учебником еще только начиналась, планировалось участие в авторском коллективе профессора Ю.И.Харкаца, однако он безвременно скончался в начале 1999 г. В ходе
предварительного обсуждения плана учебника Юрий Исаакович
высказал ряд важных соображений, которые мы в меру своих
возможностей постарались учесть в нескольких разделах.
В предлагаемое читателям третье издание внесены многочисленные дополнения и изменения, а также исправления опечаток
и неточностей. Авторы благодарят коллег, высказавших замечания к первому изданию учебника.
Мы глубоко благодарны также доценту С.Ю. Васильеву и научному сотруднику 3.В. Кузьминовой за неоценимую техническую помощь при подготовке оригинал-макета.
ВВЕДЕНИЕ
Термин «электрохимия» объединяет два вида явлений:
электрические и химические. Однако любой химический процесс связан с перегруппировкой заряженных частиц — атомных
ядер и электронов, а потому химические и электрические явления, строго говоря, неразделимы. Таким образом, понятие электрохимии как одного из разделов химической науки уже, чем
это вытекает из ее названия. Чтобы установить круг явлений,
которые рассматриваются электрохимией, необходимо остановиться на различии между химической и электрохимической
реакциями.
Любую окислительно-восстановительную химическую реакцию можно рассматривать с точки зрения сопряженных процессов окисления и восстановления. Например, в реакции образования воды
2Н2 + 02 → 2Н2О (А)
атомы кислорода восстанавливаются (принимают электроны), а
атомы водорода окисляются (отдают электроны). Если слить растворы солей двухвалентного железа и четырехвалентного церия,
то в химической реакции
Fe(II) + Ce(IV) → Fe(III) + Се(Ш) (Б)
роль окислителя будет играть ион Ce(IV), а роль восстановителя — ион Fe(II)1. Условием протекания химической реакции в
приведенных примерах является возникновение электронного
перекрывания, возможного только при сближении реагирующих
частиц на достаточно малое расстояние. В результате такого перекрывания становится возможным переход электрона от восстановителя к окислителю.
Если реакции осуществляются в объеме раствора (гомогенные
реакции), то никаких ограничений на местонахождение реакционной зоны не накладывается.
1 Римские цифры в скобках обозначают степень окисления, а не заряд иона, поскольку в зависимости от состава раствора возможно образование комплексных
ионов разного состава и зарядности. Только для сольватокомплексов, в частности для устойчивых гидратированных ионов, заряд которых совпадает со степенью окисления, используется традиционное обозначение заряда иона арабскими
цифрами.
Реакции (А) и (Б) можно осуществить и электрохимическим
путем. При этом окислитель и восстановитель пространственно разделены, а передача электронов
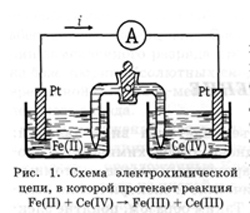
осуществляется при помощи металлических проводников (рис. 1).
Пластинка из платины, опущенная в раствор с ионами Fe(II), является электродом, который принимает электроны:
Fe (II) + Pt → Fe (III) + e (Pt)
Этот электрод называют анодом. Электроны по внешней цепи
переходят с анода на другой платиновый электрод, погруженный
в раствор с ионами Ce(IV). На этом электроде (катоде) происходит реакция восстановления:
Ce(IV) + e→(Pt) → Ce(III) + Pt.
Таким образом, в результате суммирования процессов на катоде и аноде осуществляется реакция (Б). Аналогичным образом, подводя кислород и водород к двум платиновым электродам, погруженным в раствор кислоты, можно осуществить и
реакцию (А):
на аноде Н2 + 2Н2О + Pt → 2Н3О+ + 2e-(Pt);
на катоде 1/2O2+ 2Н3О+ + 2e-(Pt) → ЗН2О + Pt.
Электрохимические реакции являются гетерогенными, т.е.
могут протекать только вблизи межфазной границы. Перенос
электрона оказывается в данном случае следствием электронного
перекрывания между одним из реагентов и электродом, поэтому
условием переноса становится приближение реагента к электроду.
Соответственно, для электродных реакций, в отличие от гомогенных, очень важную роль играет строение границы раздела между
электродом и раствором. Существенное значение имеет также направленность потоков окислителя и восстановителя (в ходе гетерогенной реакции поток частиц реагента всегда направлен к поверхности электродов, а поток частиц продуктов реакции — от
поверхности электродов в объем раствора или в объем электрода).
Важным следствием этих различий является то, что большая
часть энергии химического превращения при электрохимическом способе проведения реакции превращается в электрическую
энергию, тогда как в условиях постоянного объема вся энергия
гомогенной химической реакции выделяется в виде теплоты.
Вследствие характерных особенностей электрохимических процессов электрохимия выделяется в самостоятельный раздел физической химии.
Как видно из рис. 1, для осуществления электрохимической
реакции необходима некоторая система — электрохимическая
цепь. Основные элементы такой цепи — металлические или полупроводниковые электроды, проводник второго рода (конденсированная ионная система — раствор электролита, его расплав
или твердый электролит) и границы раздела фаз: между металлом или полупроводником и электролитом, между двумя различными металлами и/или полупроводниками и между двумя различными электролитами.
Закономерности протекания тока в электрохимической цепи,
а также закономерности электрохимического равновесия определяются свойствами всех этих элементов. Строение металлов и
полупроводников, а также их электропроводность много лет традиционно являлись предметом физических, а не химических исследований, поэтому электрохимия изучала в основном ионные
системы (проводники второго рода) и границы раздела фаз с точки зрения их структуры и механизма переноса заряженных частиц. В настоящее время происходит резкое расширение круга
электродных материалов, и рамки электрохимических исследований все больше раздвигаются, аккумулируя традиционные физические направления.
Для электрохимических процессов, протекающих на межфазных границах, естественно, применимы законы сохранения вещества и энергии
Закон сохранения вещества применительно к электрохимическим превращениям на электродах принимает форму двух хорошо известных законов Фарадея:
1) количество вещества, прореагировавшего на электроде при
пропускании постоянного электрического тока, пропорционально силе тока и времени электролиза;
2) при постоянном количестве пропущенного через электрод
электричества масса продукта реакции пропорциональна его
химическому эквиваленту.
1В отличие от проводников первого рода, электропроводность которых определяется движением свободных электронов или дырок, проводниками второго рода
принято называть системы, электропроводность которых в основном обеспечивается перемещением ионов.
Оба закона Фарадея можно объединить следующим простым
выражением:
n=Q/F,
где п — число грамм-эквивалентов вещества, вступившего в электрохимическую реакцию при пропускании через границу раздела фаз Q кулонов электричества; F = 96485 Кл/г • экв — число Фарадея.
Что же касается закона сохранения энергии при электрохимических превращениях, то для его конкретизации требуется углубленное исследование как равновесных, так и неравновесных
свойств электрохимических систем.
Итак, электрохимия — это раздел химической науки, в котором изучаются физико-химические свойства конденсированных
ионных систем, а также процессы и явления на границах раздела
фаз с участием заряженных частиц (электронов или ионов).
Электрохимия, таким образом, охватывает все формы взаимодействия между подвижными заряженными частицами в конденсированных фазах — как в состоянии равновесия, так и при протекании реакций на границе раздела и в объеме фаз.
Возникновение электрохимии, изучающей свойства и закономерности электрохимических цепей, связано с построением первой такой цепи. В 1791 г. итальянский естествоиспытатель
Л. Гальвани, изучая физиологические свойства препарированной
лягушки, случайно реализовал своеобразную электрохимическую цепь, состоящую из мышцы лягушки и двух различных металлов. В 1800 г. другой итальянский ученый А. Вольта сконструировал первый химический источник тока — «вольтов столб»,
который состоял из серебряных и оловянных электродов, разделенных пористыми прокладками, смоченными раствором соли.
После этого события необычные свойства электрохимических цепей стали предметом изучения новой науки — электрохимии.
Электрохимическая цепь (см. рис. 1) работает как химический источник тока: в ней электрический ток возникает в результате самопроизвольно протекающей реакции (Б). Наоборот, при
помощи электрохимической цепи и внешнего источника тока
можно осуществлять различные химические превращения в растворе или расплаве электролита. Такая электрохимическая цепь
работает как электролизер. Простейший пример электролиза —
разложение воды на кислород и водород.
И работа химических источников тока, и процессы электролиза имеют большое практическое значение. Теоретическая
электрохимия на основе законов, которым подчиняется поведение электрохимических цепей, позволяет сделать рациональный
выбор системы и установить наиболее оптимальный режим работы источника тока или электролизера. Кроме того, электрохимия имеет фундаментальное общетеоретическое значение, поскольку рассматривает закономерности перехода электронов при
протекании химических и электрохимических реакций.
Один из традиционных разделов теоретической электрохимии — теория электролитов — занимается изучением как равновесных, так и неравновесных свойств гомогенных систем — электролитов (иногда этот раздел называют ионикой). Другой раздел — электрохимия гетерогенных систем — изучает общие
условия равновесия на заряженных границах раздела фаз, строение этих границ, механизм и кинетические закономерности перехода заряженных частиц через межфазные границы (в этом случае иногда употребляют термин электродика). Такая классификация является не вполне совершенной. Она справедлива в том
случае, если границы раздела возникают между однофазными
проводниками первого и второго рода, и, следовательно, на таких
границах изменяется характер электрической проводимости:
электронная проводимость металла или полупроводника сменяется ионной проводимостью раствора, расплава или твердого
электролита. Однако многие конденсированные ионные системы,
выступающие в качестве реальных электролитов, заведомо неоднофазны. В то же время многие проводники второго рода или
композиции со смешанной проводимостью могут функционировать как электродные материалы (т. е. источники или акцепторы
электронов в ходе электрохимических реакций). В этих условиях
необходима более сложная классификация, не вполне пока сформировавшаяся. Поэтому в книге в целом сохранена принятая ранее упрощенная структура
|